前車(chē)之鑒��,后事之師�。近日,上海藥監(jiān)局發(fā)布《2022年上海市第二類有源醫(yī)療器械變更注冊(cè)技術(shù)審評(píng)常見(jiàn)問(wèn)題分析》�,2022年上海市醫(yī)療器械化妝品審評(píng)核查中心共計(jì)受理第二類有源醫(yī)療器械變更注冊(cè)157件,其中40件進(jìn)行了發(fā)補(bǔ)���,發(fā)補(bǔ)率25.4%����。下面對(duì)技術(shù)審評(píng)發(fā)補(bǔ)常見(jiàn)問(wèn)題進(jìn)行分析�。
前車(chē)之鑒,后事之師���。近日�����,上海藥監(jiān)局發(fā)布《2022年上海市第二類有源醫(yī)療器械變更注冊(cè)技術(shù)審評(píng)常見(jiàn)問(wèn)題分析》���,2022年上海市醫(yī)療器械化妝品審評(píng)核查中心共計(jì)受理第二類有源醫(yī)療器械變更注冊(cè)157件�,其中40件進(jìn)行了發(fā)補(bǔ)����,發(fā)補(bǔ)率25.4%。下面對(duì)技術(shù)審評(píng)發(fā)補(bǔ)常見(jiàn)問(wèn)題進(jìn)行分析��。
一����、上海第二類有源醫(yī)療器械變更注冊(cè)審評(píng)發(fā)補(bǔ)意見(jiàn)分布情況
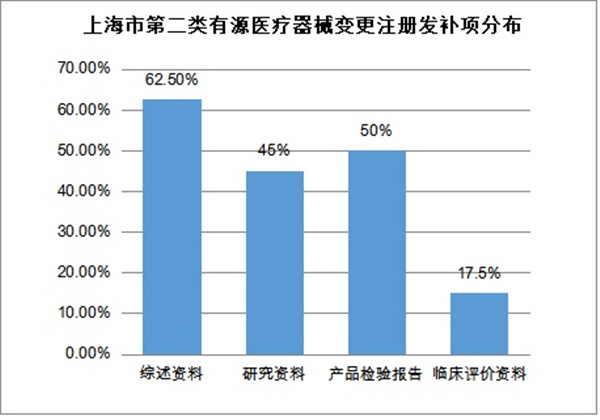
變更注冊(cè)發(fā)補(bǔ)40件,涉及33家企業(yè)���。主要集中在綜述資料��、研究資料���、產(chǎn)品檢驗(yàn)報(bào)告、臨床評(píng)價(jià)資料�、注冊(cè)單元及產(chǎn)品管理類別�、申請(qǐng)表六部分���。其中綜述資料發(fā)補(bǔ)率62.5%��,研究資料發(fā)補(bǔ)率45%����,產(chǎn)品檢驗(yàn)報(bào)告50%����,臨床評(píng)價(jià)資料發(fā)補(bǔ)率17.5%�����。
二�、醫(yī)療器械變更注冊(cè)審評(píng)常見(jiàn)問(wèn)題分析
1、醫(yī)療器械注冊(cè)單元及產(chǎn)品管理類別問(wèn)題
根據(jù)《醫(yī)療器械注冊(cè)單元?jiǎng)澐种笇?dǎo)原則》���,產(chǎn)品技術(shù)原理�、結(jié)構(gòu)組成����、性能指標(biāo)����、適用范圍不同時(shí)�����,原則上劃分為不同注冊(cè)單元�����。例如移動(dòng)式攝影X射線機(jī)進(jìn)行變更注冊(cè)時(shí)���,以新增型號(hào)高壓發(fā)生器為例�,需要詳述變更高壓發(fā)生器后�����,新增產(chǎn)品型號(hào)與原產(chǎn)品型號(hào)屬于同一注冊(cè)單元的理由����,包括原材料、結(jié)構(gòu)組成等����。高壓發(fā)生裝置中的高壓變壓器結(jié)構(gòu)不一致的(如:工頻和非工頻)�,不能劃為同一注冊(cè)單元����,建議企業(yè)進(jìn)行首次注冊(cè)申報(bào)。
部分產(chǎn)品變更注冊(cè)后產(chǎn)品管理類別發(fā)生變化�,例如醫(yī)學(xué)影像處理軟件變更后可提供治療計(jì)劃制定等臨床診療建議,變更后的產(chǎn)品應(yīng)按照第三類醫(yī)療器械管理�����,建議企業(yè)在提交資料前應(yīng)明確產(chǎn)品管理類別���。
2、申請(qǐng)表常見(jiàn)問(wèn)題
申請(qǐng)表中“變更內(nèi)容”描述不清���,或與提交的《變更情況說(shuō)明》中的變更內(nèi)容不一致�。如《申請(qǐng)表》中描述產(chǎn)品結(jié)構(gòu)組成有變化��,但《變更情況說(shuō)明》中陳述變更內(nèi)容不涉及產(chǎn)品結(jié)構(gòu)組成的變化�����?����!渡暾?qǐng)表》應(yīng)詳細(xì)描述需要進(jìn)行變更注冊(cè)的內(nèi)容,如有必要����,請(qǐng)以《申請(qǐng)表》的附件形式進(jìn)行詳細(xì)、完整的描述�����。
3���、綜述資料常見(jiàn)問(wèn)題
企業(yè)未根據(jù)《關(guān)于公布醫(yī)療器械注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告》編寫(xiě)申報(bào)產(chǎn)品的綜述資料��,存在主要問(wèn)題如下:
(1)產(chǎn)品變更情況說(shuō)明:對(duì)變更的具體內(nèi)容描述不充分���,無(wú)法充分了解產(chǎn)品變更內(nèi)容。未詳細(xì)描述產(chǎn)品變更部分的工作原理���、技術(shù)參數(shù)��、結(jié)構(gòu)組成和涉及的軟硬件變動(dòng)及臨床操作使用情況����;變更新增型號(hào)命名不合理,劃分說(shuō)明未體現(xiàn)型號(hào)間差異�����;未提供新增型號(hào)產(chǎn)品的主要元器件清單(包括元器件的名稱��、型號(hào)���、技術(shù)參數(shù)��、材質(zhì)��、供應(yīng)商信息等)和新增型號(hào)產(chǎn)品的彩色照片����,根據(jù)產(chǎn)品具體變更情況提供相應(yīng)的說(shuō)明對(duì)比表�����。
(2)綜述資料涉及軟件相關(guān)部分:未按《醫(yī)療器械軟件注冊(cè)審查指導(dǎo)原則(2022年修訂版)》提交軟件更新資料�;未提交新增軟件功能的詳細(xì)設(shè)計(jì)說(shuō)明����,未明確新增軟件功能涉及的核心算法及相關(guān)參數(shù)�。
4����、研究資料常見(jiàn)問(wèn)題
(1)性能研究:未對(duì)變更的差異部分對(duì)產(chǎn)品安全有效性的影響進(jìn)行風(fēng)險(xiǎn)分析;涉及新增部件或原材料變化��,未判斷變更部分對(duì)產(chǎn)品有效性的影響�,以纖維輸尿管腎鏡新增型號(hào)為例,新增產(chǎn)品型號(hào)在結(jié)構(gòu)組成中增加不銹鋼管部分�,增加該部分后,需提供產(chǎn)品的理化性能���、光學(xué)性能��、電氣絕緣性能�、防水性能����、連接頭拉力性能等方面的研究資料;
(2)軟件研究:涉及軟件變化及新增軟件模塊����,未按照軟件指導(dǎo)原則提供相應(yīng)資料����,例如視力篩選儀新增了光反射軟件功能����,但申報(bào)資料對(duì)此功能的相關(guān)功能原理、相關(guān)指標(biāo)要求及相關(guān)依據(jù)性資料未進(jìn)行詳細(xì)介紹且未提供相應(yīng)的依據(jù)性資料���。
5����、產(chǎn)品檢驗(yàn)報(bào)告常見(jiàn)問(wèn)題
未提交針對(duì)性能指標(biāo)及檢驗(yàn)方法實(shí)質(zhì)性變更的檢驗(yàn)報(bào)告�,常見(jiàn)問(wèn)題有:
(1)未提交性能指標(biāo)和檢驗(yàn)方法變化的合理理由;
(2)未提交性能指標(biāo)和檢驗(yàn)方法變化后的產(chǎn)品檢驗(yàn)報(bào)告���;
(3)檢驗(yàn)報(bào)告未包括涉及變更部分全部項(xiàng)目的檢驗(yàn)結(jié)果���。
6、臨床評(píng)價(jià)資料常見(jiàn)問(wèn)題
企業(yè)申請(qǐng)變更適用范圍���,但未提交相應(yīng)的臨床評(píng)價(jià)資料,如人工耳蝸聲音處理器更改產(chǎn)品適用范圍��,在原適用范圍中增加了適配的人工耳蝸植入體型號(hào),但未提交相應(yīng)的臨床評(píng)價(jià)資料��。
備注:以上分析按照《關(guān)于公布醫(yī)療器械注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告》的申報(bào)資料先后順序排序�����。
三���、 對(duì)上海市第二類有源醫(yī)療器械變更注冊(cè)的建議
本文對(duì)2022年上海市第二類有源醫(yī)療器械變更注冊(cè)常見(jiàn)發(fā)補(bǔ)問(wèn)題進(jìn)行了梳理與分析����,其中最常見(jiàn)的三個(gè)主要問(wèn)題集中在:綜述資料�、產(chǎn)品檢驗(yàn)報(bào)告、研究資料���。
綜述資料部分��,企業(yè)應(yīng)當(dāng)詳細(xì)描述本次變更情況����、變更的具體原因及目的����,讓審評(píng)人員對(duì)變更產(chǎn)品能有整體的把握和了解���,使產(chǎn)品的風(fēng)險(xiǎn)能更清晰地被識(shí)別。在產(chǎn)品變更情況描述部分���,根據(jù)產(chǎn)品具體變更情況提供相應(yīng)的說(shuō)明及對(duì)比表����,包括產(chǎn)品技術(shù)要求變更對(duì)比表��,結(jié)構(gòu)組成對(duì)比表�,適用范圍對(duì)比表等。
關(guān)于研究資料�����,建議企業(yè)根據(jù)《關(guān)于公布醫(yī)療器械注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告》進(jìn)行編寫(xiě)�,根據(jù)變更產(chǎn)品的技術(shù)特征,提供研究綜述�,逐項(xiàng)描述所開(kāi)展的研究,提供相應(yīng)的研究資料�����。研究資料應(yīng)當(dāng)包括產(chǎn)品性能指標(biāo)的確定依據(jù)�、設(shè)計(jì)輸入來(lái)源等內(nèi)容���。研究資料應(yīng)當(dāng)足夠充分�,能夠證明產(chǎn)品的安全性和有效性。對(duì)于包含軟件組件的產(chǎn)品��,也應(yīng)當(dāng)根據(jù)《醫(yī)療器械軟件注冊(cè)審查指導(dǎo)原則(2022年修訂版)》的要求提交產(chǎn)品軟件研究資料���。
在產(chǎn)品檢驗(yàn)報(bào)告部分�,應(yīng)關(guān)注產(chǎn)品技術(shù)要求變化部分�,應(yīng)提供變化后的檢驗(yàn)報(bào)告,檢驗(yàn)報(bào)告應(yīng)包括變更部分的全項(xiàng)檢測(cè)��,送檢樣品應(yīng)能覆蓋所有型號(hào)規(guī)格���。
如有上海第二類醫(yī)療器械變更注冊(cè)咨詢服務(wù)需求�,歡迎您隨時(shí)方便與杭州證標(biāo)客醫(yī)藥技術(shù)咨詢有限公司聯(lián)絡(luò)�,聯(lián)系人:葉工,電話:18058734169����,微信同。