2019年4月18日��,為加強(qiáng)醫(yī)療器械產(chǎn)品注冊工作的監(jiān)督和指導(dǎo)�,進(jìn)一步提高注冊審查質(zhì)量,國家藥品監(jiān)督管理局組織制定了《醫(yī)療器械動物實(shí)驗(yàn)研究技術(shù)審查指導(dǎo)原則 第一部分:決策原則》��。這是開展動物實(shí)驗(yàn)判定路徑依據(jù)����,具有里程碑的意義�。這是國家藥監(jiān)部門首次發(fā)布關(guān)于動物實(shí)驗(yàn)的官方文件�����,結(jié)束了醫(yī)療器械動物實(shí)驗(yàn)長期無規(guī)可循的局面�����。
引言:2019年4月18日,國家藥監(jiān)局發(fā)布《關(guān)于發(fā)布醫(yī)療器械動物實(shí)驗(yàn)研究和腹腔內(nèi)置疝修補(bǔ)補(bǔ)片動物實(shí)驗(yàn)2項技術(shù)審查指導(dǎo)原則的通告(2019年 第18號)》����,如下:
醫(yī)療器械動物實(shí)驗(yàn)研究技術(shù)審查指導(dǎo)原則第一部分:決策原則
一、前言
醫(yī)療器械安全性和有效性評價研究應(yīng)采用科學(xué)����、合理的評價方法,其中動物實(shí)驗(yàn)是重要手段之一����,其屬于產(chǎn)品設(shè)計開發(fā)中的重要研究,可為產(chǎn)品設(shè)計定型提供相應(yīng)的證據(jù)支持����;若需開展臨床試驗(yàn)����,可為醫(yī)療器械能否用于人體研究提供支持,降低臨床試驗(yàn)受試者及使用者的風(fēng)險以及為臨床試驗(yàn)設(shè)計提供參考����。
但并不是所有醫(yī)療器械均需要通過動物實(shí)驗(yàn)驗(yàn)證產(chǎn)品安全性和有效性。為了對開展動物實(shí)驗(yàn)的必要性判定提供指導(dǎo)��,特制訂本原則。
本原則為醫(yī)療器械動物實(shí)驗(yàn)研究技術(shù)審查指導(dǎo)原則系列中的第一部分����,為判定是否開展醫(yī)療器械動物實(shí)驗(yàn)的決策原則,關(guān)于動物實(shí)驗(yàn)設(shè)計等其他方面的內(nèi)容請參見其他部分指導(dǎo)原則��。
本原則是供申請人和技術(shù)審評人員使用的技術(shù)指導(dǎo)性文件�,不涉及注冊審批等行政事項,亦不作為法規(guī)強(qiáng)制執(zhí)行��,如有能夠滿足法規(guī)要求的其他方法�,也可以采用,但應(yīng)提供充分的研究資料和驗(yàn)證資料��。應(yīng)在遵循相關(guān)法規(guī)的前提下使用本原則����。
本原則是在現(xiàn)行法規(guī)和標(biāo)準(zhǔn)體系以及當(dāng)前認(rèn)知水平下制訂的,隨著法規(guī)和標(biāo)準(zhǔn)的不斷完善�����,以及科學(xué)技術(shù)的不斷發(fā)展�,本原則相關(guān)內(nèi)容也將進(jìn)行適時地調(diào)整。
二���、適用范圍
本原則適用于決策醫(yī)療器械是否需在活體動物上進(jìn)行在體實(shí)驗(yàn)�����,不包括在非活體動物����、離體組織或器官上進(jìn)行的研究。
以下情況可參考本原則:
(一)醫(yī)療器械申請人在設(shè)計開發(fā)階段確定是否需要開展動物實(shí)驗(yàn)時�����;
(二)醫(yī)療器械監(jiān)管機(jī)構(gòu)在技術(shù)審評環(huán)節(jié)評價開展動物實(shí)驗(yàn)的必要性時����。
本原則不替代GB/T 16886系列標(biāo)準(zhǔn)等醫(yī)療器械生物學(xué)評價相關(guān)的技術(shù)文件。如通過動物實(shí)驗(yàn)方式評價醫(yī)療器械的生物相容性�����,亦應(yīng)符合GB/T 16886系列標(biāo)準(zhǔn)等生物學(xué)評價相關(guān)技術(shù)文件�����。
如有針對特定產(chǎn)品的指導(dǎo)原則發(fā)布����,則遵循相應(yīng)產(chǎn)品的指導(dǎo)原則。
本原則不適用于按照醫(yī)療器械管理的體外診斷試劑����。
醫(yī)療器械臨床試驗(yàn)倫理審查時,可參考本原則中適用部分以評估臨床前動物實(shí)驗(yàn)的必要性���。
三�����、基本決策原則
在醫(yī)療器械設(shè)計開發(fā)階段��,決策是否開展動物實(shí)驗(yàn)時����,建議考慮動物福利倫理原則及風(fēng)險管理原則�����。
(一)動物福利倫理原則
申請人需遵循動物實(shí)驗(yàn)的“替代(Replacement)�����、減少(Reduction)和優(yōu)化(Refinement)”原則,即3R原則�。
申請人在決策是否開展動物實(shí)驗(yàn)前,需要特別考慮動物福利倫理����,充分開展實(shí)驗(yàn)室研究,不宜采用動物實(shí)驗(yàn)替代實(shí)驗(yàn)室研究��。
若有經(jīng)過確認(rèn)/驗(yàn)證的非活體研究�����、計算機(jī)模擬等方法����,則優(yōu)先采用上述方法以替代動物實(shí)驗(yàn)。
申請人宜充分利用已有的信息獲取產(chǎn)品安全性����、有效性和可行性的相關(guān)證據(jù),如可利用已有的同類產(chǎn)品動物實(shí)驗(yàn)數(shù)據(jù)或通過與市售同類產(chǎn)品進(jìn)行性能比對等方式驗(yàn)證產(chǎn)品的安全性�����、有效性和可行性�����。若相關(guān)證據(jù)充分���,可免于動物實(shí)驗(yàn)��。
(二)風(fēng)險管理原則
申請人在醫(yī)療器械設(shè)計開發(fā)時應(yīng)進(jìn)行充分的風(fēng)險管理活動�����。風(fēng)險控制作為風(fēng)險管理的重要部分��,是將風(fēng)險降低并維持在規(guī)定水平的過程����。實(shí)施每一項風(fēng)險控制措施后應(yīng)對其有效性予以驗(yàn)證(其中包括確認(rèn)活動)���。實(shí)驗(yàn)室研究或動物實(shí)驗(yàn)等均是驗(yàn)證風(fēng)險控制措施有效性的手段����,申請人宜盡可能地通過前期研究(如實(shí)驗(yàn)室研究等)對已識別風(fēng)險的控制措施有效性進(jìn)行驗(yàn)證�����,只有在實(shí)驗(yàn)室研究不足時,才考慮通過動物實(shí)驗(yàn)開展進(jìn)一步驗(yàn)證��。動物實(shí)驗(yàn)資料可作為風(fēng)險/受益分析時的支持性資料�����。
如需通過動物實(shí)驗(yàn)進(jìn)行風(fēng)險控制措施有效性的驗(yàn)證�,則結(jié)合動物實(shí)驗(yàn)?zāi)康模话銖目尚行?、有效性、安全性三方面進(jìn)行考慮:
1. 可行性
可行性研究是指產(chǎn)品設(shè)計開發(fā)階段進(jìn)行的����,對產(chǎn)品工作原理、作用機(jī)理���、設(shè)計�、可操作性��、功能性���、安全性等方面進(jìn)行確認(rèn)/驗(yàn)證�,或識別新的非預(yù)期風(fēng)險的研究,如生物可吸收支架平臺材料的篩選�、經(jīng)導(dǎo)管瓣膜置換裝置的設(shè)計可行性����、迭代設(shè)計更新的驗(yàn)證等。
2. 有效性
盡管動物與人體之間����,在部分醫(yī)療器械的有效性方面可能存在一定差異,但設(shè)計合理的動物實(shí)驗(yàn)可支持產(chǎn)品的有效性(包括性能和操作)���,如可吸收防粘連醫(yī)療器械的防粘連性能評價�,組織修復(fù)材料引導(dǎo)組織重建的有效性評價�����,多孔涂層關(guān)節(jié)類產(chǎn)品或3D打印多孔結(jié)構(gòu)產(chǎn)品的骨結(jié)合效果評價等���。
3. 安全性
申請人采取風(fēng)險控制措施后��,部分產(chǎn)品安全性可適當(dāng)采用動物實(shí)驗(yàn)研究進(jìn)行評價���,如含藥醫(yī)療器械中藥物安全性范圍研究��,通過組織病理學(xué)等方式的毒理學(xué)評價�、產(chǎn)品對生物體的損傷評價��,動物源性材料的抗鈣化性能����,外科血管閉合設(shè)備的血管熱損傷研究,防粘連器械與組織粘連相關(guān)并發(fā)癥的評價等���。
實(shí)驗(yàn)?zāi)康挠袝r是不能嚴(yán)格劃分界限的��,因此一項動物實(shí)驗(yàn)可能同時對產(chǎn)品的可行性����、有效性��、安全性進(jìn)行評價�����。
若產(chǎn)品采用新的作用機(jī)理���、工作原理���、設(shè)計�、主要材料/配方�、應(yīng)用方法(如手術(shù)操作)、預(yù)期用途�����、增加新的適用范圍��、改進(jìn)某方面性能等�����,申請人應(yīng)針對產(chǎn)品創(chuàng)新點(diǎn)相關(guān)風(fēng)險進(jìn)行評估�,并考慮通過動物實(shí)驗(yàn)對風(fēng)險控制措施的有效性進(jìn)行驗(yàn)證�����。
申請人可參考以下決策流程圖進(jìn)行是否開展動物實(shí)驗(yàn)的決策�。
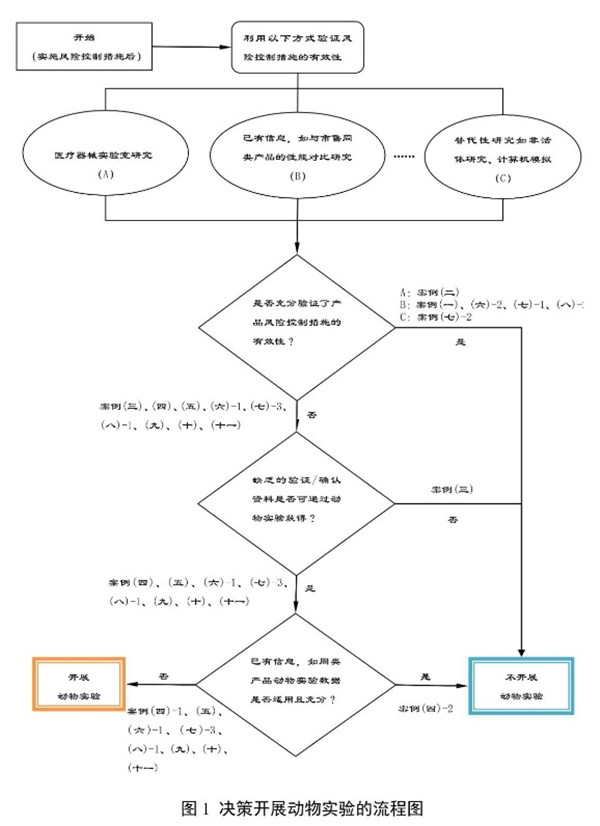
四、是否開展動物實(shí)驗(yàn)的決策案例
附頁列出了部分可能需要開展動物實(shí)驗(yàn)的產(chǎn)品示例��,需要注意的是���,在不同的具體情形下�,根據(jù)決策原則對于同樣的產(chǎn)品可能將得出不同的判定結(jié)果;另外����,對于表中未列的醫(yī)療器械產(chǎn)品,在某些具體情形下也可能需要開展動物實(shí)驗(yàn)����。建議申請人根據(jù)產(chǎn)品實(shí)際情況參照決策流程圖予以判定。
為便于理解決策原則����,本章節(jié)列舉了以下實(shí)際案例。相關(guān)案例僅針對特定產(chǎn)品在具體情形下的決策判定�����,例如同一申請人在前代植入式心臟起搏器基礎(chǔ)上對產(chǎn)品功能的改進(jìn)或更新��,再例如采用新材料制造的腸道吻合器等��。
(一)多孔涂層生物型髖關(guān)節(jié)假體
多孔涂層生物型髖關(guān)節(jié)假體的主要風(fēng)險包括產(chǎn)品骨結(jié)合效果欠佳或涂層剝落造成的假體固定失敗等��,通過動物實(shí)驗(yàn)可評價涂層的骨結(jié)合效果。如果通過涂層的成分表征���、形貌及體視學(xué)數(shù)據(jù)(厚度���、孔隙率、孔隙尺度等)�����、涂層機(jī)械性能評價(涂層與基體結(jié)合強(qiáng)度等)�、涂層穩(wěn)定性及耐腐蝕性能評價、生物相容性評價等研究證明其與已上市同類產(chǎn)品的涂層具有等同性�,則無需通過動物實(shí)驗(yàn)來評估多孔涂層的骨結(jié)合效果和涂層的穩(wěn)定性���。
(二)心電圖機(jī)
心電圖機(jī)的主要風(fēng)險之一是工作數(shù)據(jù)的不準(zhǔn)確性��,包括心電圖自動測量的不準(zhǔn)確性和心電圖自動診斷的不準(zhǔn)確性�����?���?蛇M(jìn)行實(shí)驗(yàn)室研究��,通過心電圖標(biāo)準(zhǔn)數(shù)據(jù)庫來驗(yàn)證心電圖自動測量的準(zhǔn)確性,可通過形態(tài)診斷用心電圖數(shù)據(jù)庫和節(jié)律診斷用心電圖數(shù)據(jù)庫來確認(rèn)公開形態(tài)解釋的準(zhǔn)確性和公開節(jié)律診斷的準(zhǔn)確性���,無需開展動物實(shí)驗(yàn)��。
(三)注射用交聯(lián)透明質(zhì)酸鈉凝膠
交聯(lián)透明質(zhì)酸鈉凝膠可用于面部注射以糾正鼻唇溝皺紋����,糾正效果一般可達(dá)到6個月���。鑒于通過動物實(shí)驗(yàn)無法考察人體面部皺紋的改善程度�,故一般不采用動物實(shí)驗(yàn)數(shù)據(jù)支持該類產(chǎn)品的有效性��,建議在人體臨床評價資料中關(guān)注產(chǎn)品注射6個月時的鼻唇溝皺紋嚴(yán)重程度分級(如WSRS)較術(shù)前的改善程度等療效評價指標(biāo)��。
(四)可吸收生物疝修補(bǔ)補(bǔ)片
本案例提及的可吸收生物疝修補(bǔ)補(bǔ)片用于修復(fù)腹壁疝及腹壁缺損�,一般具有類似細(xì)胞外基質(zhì)的微觀結(jié)構(gòu)。產(chǎn)品植入人體后�,宿主細(xì)胞在材料中生長,最終重塑出的腹壁組織對缺損進(jìn)行修補(bǔ)����。
1. 該類產(chǎn)品最主要的風(fēng)險之一在于疝或腹壁缺損的復(fù)發(fā),宜采取一系列風(fēng)險控制措施確保產(chǎn)品組織重建的有效性,以降低疝復(fù)發(fā)的風(fēng)險�。對于該類產(chǎn)品,僅僅依靠常規(guī)的實(shí)驗(yàn)室研究并不能驗(yàn)證疝復(fù)發(fā)風(fēng)險相關(guān)控制措施的有效性���,宜考慮使用組織病理學(xué)等動物實(shí)驗(yàn)數(shù)據(jù)驗(yàn)證組織重建效果�。
2. 申請人在開展動物實(shí)驗(yàn)前可收集已有同類產(chǎn)品的動物實(shí)驗(yàn)資料或文獻(xiàn)數(shù)據(jù)���,并分析這些數(shù)據(jù)能否用于支持申報產(chǎn)品組織重建效果的評價�����,如現(xiàn)有資料充分則無需開展動物實(shí)驗(yàn)����。
(五)體外除顫產(chǎn)品
體外除顫產(chǎn)品供不同的使用者和操作者在不同的預(yù)期使用環(huán)境下進(jìn)行體外電復(fù)律治療��。
對于該類產(chǎn)品����,常規(guī)的實(shí)驗(yàn)室研究并不能驗(yàn)證體外電復(fù)律技術(shù)風(fēng)險相關(guān)控制措施的有效性���,因此宜使用活體動物開展實(shí)驗(yàn)獲得除顫研究數(shù)據(jù)進(jìn)行驗(yàn)證�����。
(六)超聲軟組織切割止血系統(tǒng)
超聲軟組織切割止血系統(tǒng)用于軟組織切割和血管閉合產(chǎn)品通過摩擦產(chǎn)生的熱量導(dǎo)致組織凝固后被切開���、封閉血管(本例子不包含3mm以上血管的切割和閉合功能的特殊要求)����。
1. 該產(chǎn)品主要風(fēng)險包括產(chǎn)品設(shè)計不合理等原因可能造成的血管切割閉合不充分和組織熱損傷等�����。僅依靠實(shí)驗(yàn)室研究無法充分驗(yàn)證這些風(fēng)險的控制措施是否有效,需要通過急性動物實(shí)驗(yàn)觀察產(chǎn)品的即刻的血管切割閉合情況和組織熱損傷情況��,需要通過慢性動物實(shí)驗(yàn)觀察熱損傷愈合情況和繼發(fā)出血情況����,進(jìn)而驗(yàn)證風(fēng)險控制措施的有效性。
2. 若申請的產(chǎn)品包含多個類似設(shè)計的刀頭�,可在開展動物試驗(yàn)前通過體外爆破壓力實(shí)驗(yàn)篩選出性能最差的刀頭開展動物實(shí)驗(yàn),以起到減免部分動物實(shí)驗(yàn)的目的�。對于新增與已有刀頭相似(設(shè)計類似、性能相近)的刀頭��,可使用體外爆破壓力實(shí)驗(yàn)結(jié)果證明其與相似刀頭的等同性���,不再開展動物實(shí)驗(yàn)��。
(七)植入式心臟起搏器
1. 植入式心臟起搏器屬于高風(fēng)險植入器械��,開展動物實(shí)驗(yàn)可以為產(chǎn)品設(shè)計定型提供相應(yīng)的證據(jù)支持��。若同一申請人在前代產(chǎn)品基礎(chǔ)上進(jìn)行植入式心臟起搏器的改進(jìn)或更新����,對于前代產(chǎn)品已驗(yàn)證的內(nèi)容無需開展動物實(shí)驗(yàn),必要時申請人僅針對改進(jìn)或更新部分開展相應(yīng)的動物實(shí)驗(yàn)��。
2. 患者在植入心臟起搏器后一般不能進(jìn)行核磁共振檢查(MRI)���,如果申請人設(shè)計開發(fā)了MRI兼容的植入式心臟起搏器���,需要評估MRI環(huán)境對產(chǎn)品安全性及有效性帶來的影響,進(jìn)行MRI兼容性相關(guān)研究��。MRI兼容性研究通常需要應(yīng)用動物進(jìn)行計算機(jī)建模驗(yàn)證MRI兼容的安全性與有效性����,當(dāng)驗(yàn)證過計算機(jī)建模的準(zhǔn)確性后�,對于同一申請人其他植入式心臟起搏器產(chǎn)品的MRI兼容性研究���,可以不再重復(fù)進(jìn)行動物實(shí)驗(yàn)。
3. 無導(dǎo)線起搏器與傳統(tǒng)的植入式心臟起搏器相比�����,采用了新的結(jié)構(gòu)設(shè)計�、手術(shù)操作方法,不需要植入傳統(tǒng)的植入式心臟電極導(dǎo)線���,申請人宜針對創(chuàng)新點(diǎn)相關(guān)風(fēng)險進(jìn)行評估���,并對風(fēng)險控制措施有效性進(jìn)行驗(yàn)證或確認(rèn),申請人宜對無導(dǎo)線起搏器開展動物試驗(yàn)�����,驗(yàn)證產(chǎn)品安全性��、有效性及可行性�。
(八)藥物洗脫支架
1. 盡管藥物洗脫支架產(chǎn)品所含藥物如紫杉醇、雷帕霉素已作為藥品具有較長的臨床應(yīng)用歷史���,但在器械中應(yīng)用與其單獨(dú)作為藥品應(yīng)用時具有較大差異����,例如藥物洗脫支架植入后,靶血管壁中的局部組織藥物濃度會遠(yuǎn)遠(yuǎn)高于藥品系統(tǒng)使用后的血藥濃度�����,單純作為藥品使用的藥代及毒理學(xué)研究資料并不足以支持其安全性���,宜進(jìn)一步通過動物實(shí)驗(yàn)開展靶血管���、遠(yuǎn)端心肌等局部組織的毒理學(xué)安全性研究,獲取必要的組織病理學(xué)數(shù)據(jù)等�。對于兩個含有相同藥物的藥物洗脫支架,若支架藥物載體材料不同����,臨床應(yīng)用時同樣存在較大差異,例如藥物成分從不同載體材料中釋放�����、吸收的速率不同���,宜通過動物實(shí)驗(yàn)研究結(jié)合已有的文獻(xiàn)數(shù)據(jù)資料來確認(rèn)藥物劑量密度及安全范圍��。
2. 對于涂有可降解涂層的藥物洗脫支架產(chǎn)品����,其降解性能是載體聚合物材料篩選中一項重要因素���。通過動物實(shí)驗(yàn)在體研究藥物洗脫支架涂層的降解性能十分必要����,但如果載體聚合物(例如聚乳酸-羥基乙酸共聚物��,PLGA)的降解性能��,可通過同類產(chǎn)品信息�����、文獻(xiàn)數(shù)據(jù)信息�、材料數(shù)據(jù)庫信息、監(jiān)管機(jī)構(gòu)備案信息等獲得支持�,申請人無需對申報產(chǎn)品重新開展降解性能的動物實(shí)驗(yàn)。
(九)骨內(nèi)固定用可降解金屬螺釘
骨內(nèi)固定用可降解金屬螺釘��,該類產(chǎn)品在骨愈合初期提供初始的穩(wěn)定固定��,待骨愈合后逐漸降解,避免二次手術(shù)取出�。
該類產(chǎn)品主要風(fēng)險包括降解周期與骨愈合周期不匹配造成內(nèi)固定過早失效,以及降解產(chǎn)物對機(jī)體組織和器官帶來的安全性問題等��。對于該類產(chǎn)品�����,僅僅依靠常規(guī)的實(shí)驗(yàn)室研究并不能驗(yàn)證失效風(fēng)險相關(guān)控制措施的有效性�,需要通過適宜的動物模型的相應(yīng)部位制備骨折或骨缺損模型,評價可降解金屬產(chǎn)品在適宜的動物體內(nèi)的降解性能和產(chǎn)品的安全性及有效性��。具體試驗(yàn)項目可包含X光評價�、血液中元素分析、組織病理分析�����、micro-CT分析��、植入生物力學(xué)評價����、周圍骨組織分析等。
(十)吻合器
吻合器主要用于組織/臟器的切除、閉合���。
1. 用于實(shí)質(zhì)臟器或血管切割/吻合的吻合器類產(chǎn)品�����,因常規(guī)的實(shí)驗(yàn)室研究并不能充分驗(yàn)證吻合器用于人體的操作性能和吻合性能,宜開展動物實(shí)驗(yàn)���。
2. 對于采用了新材料的腸道或皮膚吻合器類產(chǎn)品�����,若產(chǎn)品性能�����、吻合釘材質(zhì)等與已上市產(chǎn)品存在差異性����,僅依靠常規(guī)的實(shí)驗(yàn)室研究和現(xiàn)有數(shù)據(jù)不足以評價產(chǎn)品安全性和有效性��,宜開展動物實(shí)驗(yàn)�����。另外,通過動物實(shí)驗(yàn)可確定產(chǎn)品臨床相關(guān)參數(shù)(如組織厚度等)����,預(yù)測產(chǎn)品在人體中使用時可能出現(xiàn)的安全性問題。
(十一)可吸收外科防粘連產(chǎn)品
對于可吸收外科防粘連產(chǎn)品�����,應(yīng)實(shí)現(xiàn)產(chǎn)品預(yù)期的防粘連功能�。該功能宜在適當(dāng)?shù)幕铙w動物模型上進(jìn)行研究。動物實(shí)驗(yàn)中宜盡可能地體現(xiàn)手術(shù)方法�、特定手術(shù)部位、粘連的類型��、粘連的評價方式����,以及擬在臨床應(yīng)用時的產(chǎn)品使用方法,并觀察產(chǎn)品是否能有效降低粘連的發(fā)生率�、廣泛程度及嚴(yán)重程度等。另外�����,通過動物實(shí)驗(yàn)也可以更好地為臨床研究方案設(shè)計提供參考。
五��、參考資料
[1] General Considerations for AnimalStudies for Medical Devices (Draft Guidance)
[2] EFS Guidance: Investigational Device Exemptions (IDEs)for EarlyFeasibility Medical Device Clinical studies, Including Certain First in Human (FIH)Studies
[3] Recommended Content and Formatof Test Reports for Complete Non-Clinical Bench Performance Testing inPremarket Submissions (Draft Guidance)
[4]《超聲軟組織切割止血系統(tǒng)技術(shù)審查指導(dǎo)原則》(國家食品藥品監(jiān)督管理總局通告2018年第37號)
[5]《腔鏡用吻合器產(chǎn)品注冊技術(shù)審查指導(dǎo)原則》(國家食品藥品監(jiān)督管理總局通告2017年第44號)
[6]《腹腔��、盆腔外科手術(shù)用可吸收防粘連產(chǎn)品注冊技術(shù)審查指導(dǎo)原則》(國家食品藥品監(jiān)督管理總局通告2016年第7號)
[7]《冠狀動脈藥物洗脫支架臨床前研究指導(dǎo)原則》(國家藥品監(jiān)督管理局通告2018年第21號)
[8]《體外除顫產(chǎn)品注冊技術(shù)指導(dǎo)原則》(國家食品藥品監(jiān)督管理總局通告2017年第6號)
[9]《腹腔內(nèi)置疝修補(bǔ)補(bǔ)片動物實(shí)驗(yàn)技術(shù)審查指導(dǎo)原則》
[10]《鈣磷/硅類骨填充材料注冊技術(shù)審查指導(dǎo)原則》(國家食品藥品監(jiān)督管理總局通告2017年第14號)
[11]《無源植入性醫(yī)療器械臨床試驗(yàn)審批技術(shù)審查指導(dǎo)原則》(國家藥品監(jiān)督管理局通告2018年第40號)
[12]YY/T 0316-2016《醫(yī)療器械風(fēng)險管理對醫(yī)療器械的應(yīng)用》
[13]ISO 14971:2007 Medicaldevices—Application of risk management to medical devices
[14]“Non-AnimalApproaches - The Way Forward”, European Commission Scientific Conferencesummary report, Mark Cronin, March 2017
[15] Directive 2010/63/EU of TheEuropean Parliament And of The Council on the protection of animals used forscientific purposes
六���、編寫單位:
本指導(dǎo)原則由國家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評中心編寫并負(fù)責(zé)解釋��。
標(biāo)簽:動物實(shí)驗(yàn) 醫(yī)療器械注冊 臨床試驗(yàn)