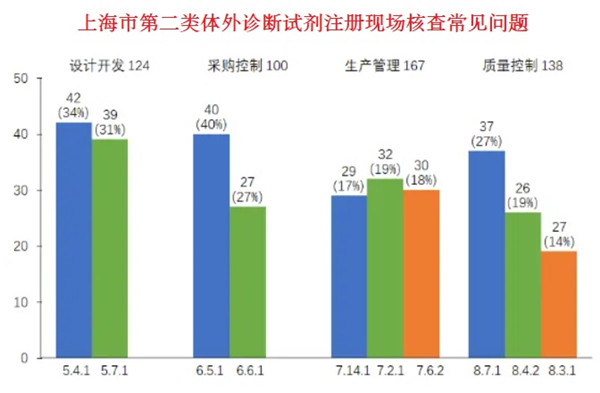
本文以上海市2023年度第二類體外診斷試劑注冊質量管理體系核查數據為基礎說明����,上海市器審中心依據《醫(yī)療器械生產質量管理規(guī)范》和《醫(yī)療器械生產質量管理規(guī)范附錄體外診斷試劑》對體外診斷試劑企業(yè)依申請開展現場核查,合計發(fā)現不符合項共666項次���。從不符合項在《規(guī)范》中各章節(jié)的分布情況來看�����,設計開發(fā)(124項次)���、采購控制(100項次)、生產管理(167項次)、質量控制(138項次)占比近八成���。
本文以上海市2023年度第二類體外診斷試劑注冊質量管理體系核查數據為基礎說明����,上海市器審中心依據《醫(yī)療器械生產質量管理規(guī)范》和《醫(yī)療器械生產質量管理規(guī)范附錄體外診斷試劑》對體外診斷試劑企業(yè)依申請開展現場核查���,合計發(fā)現不符合項共666項次����。從不符合項在《規(guī)范》中各章節(jié)的分布情況來看����,設計開發(fā)(124項次)、采購控制(100項次)�����、生產管理(167項次)�����、質量控制(138項次)占比近八成���。
上海市第二類體外診斷試劑注冊現場核查常見問題
下面將從設計開發(fā)��、采購控制�、生產管理����、質量控制四個方面對體外診斷試劑產品的常見核查問題進行梳理分析。
1.第二類體外診斷試劑注冊產品設計開發(fā)
在設計開發(fā)方面��,常見問題主要集中在條款*5.4.1和5.7.1���。
*5.4.1設計和開發(fā)輸出應當滿足輸入要求�,包括采購��、生產和服務所需的相關信息�����,產品技術要求等�。
(1)輸出不完整。
如工藝配方中投料量計算公式不完整����;說明書中未明確樣本采樣管的類型����;全血樣本未明確的抗凝劑種類����;未明確樣本稀釋液種類。
(2)輸出內容不一致�。
如產品技術要求和標準操作規(guī)程中對抗原母液濃度標定的選用方法不一致。
5.7.1應當對設計和開發(fā)進行驗證�����,以確保設計和開發(fā)輸出滿足輸入的要求����,并保持驗證結果和任何必要措施的記錄。
(3)驗證缺失�、不完整。
如未驗證說明書中標識所用全部樣本類型���;對校準品的適用機型驗證未覆蓋說明書中全部機型�;驗證用樣本非說明書適用樣本類型�。
2.采購控制
在采購控制方面,常見問題主要集中在條款6.5.1和6.6.1�����。
6.5.1采購時應當明確采購信息,清晰表述采購要求�,包括采購物品類別、驗收準則���、規(guī)格型號���、規(guī)程����、圖樣等內容。
(1)質量協議或采購要求內容不完整���。
如抗原抗體類原材料未明確生物學來源及克隆號信息�;未明確抗體類型�、生產廠家、純度等信息��。
(2)采購要求和產品技術要求等文件的規(guī)定不一致���。
如引物探針類原材料驗收標準和采購要求不一致�。
6.6.1應當對采購物品進行檢驗或驗證,確保滿足生產要求���。
(3)進貨檢驗記錄不完整���。
如未記錄檢驗用設備和試劑信息;未記錄原始檢測值�,無法體現檢測過程。
3.第二類體外診斷試劑注冊產品生產管理
在生產管理方面��,常見問題主要集中在條款*7.2.1����、7.14.1和7.6.2。
*7.2.1 應當編制生產工藝規(guī)程����、作業(yè)指導書等,明確關鍵工序和特殊過程。
(1)工藝作業(yè)指導書未明確某些工藝參數���。
如凍干作業(yè)指導書未明確溫度����、時間和真空度等參數���;未明確引物原料的投料濃度��。
(2)對關鍵工序和特殊過程的重要參數缺少驗證或確認����。
如未對烘干箱和干燥箱的最大干燥數量進行驗證。
7.14.1 應當按照物料的性狀和儲存要求進行分類存放管理���,應當明確規(guī)定中間品的儲存條件和期限���。
(3)未規(guī)定中間品的儲存條件、效期�����,或未按規(guī)定執(zhí)行��。
如未規(guī)定中間品凍融次數要求��;實際生產使用了超過有效期的中間品����。
7.6.2 生產記錄應當包括:產品名稱�、規(guī)格型號��、原材料批號�、生產批號或生產編號���、生產日期�����、數量����、主要設備�、工藝參數、操作人員等內容��。
(4)生產記錄信息不完整,不滿足可追溯要求��。
如溶液配制記錄未正確記錄配制物料名稱與數量��;未按工藝規(guī)程要求記錄穩(wěn)定時間與平衡時間及各階段產出的產物的數量��;未記錄設備編號���。
4.第二類體外診斷試劑注冊產品質量控制
在質量控制方面����,常見問題主要集中在條款*8.3.1、8.4.2和8.7.1�����。
*8.3.1 應當根據強制性標準以及經注冊或者備案的產品技術要求制定產品的檢驗規(guī)程����,并出具相應的檢驗報告或證書。
(1)檢驗規(guī)程缺失具體的檢測項目����,或檢驗規(guī)則不完整,不能有效指導操作�����。
如檢測項目未覆蓋強制性標準和產品技術要求���;未制定批間差、穩(wěn)定性項目的檢驗規(guī)則�����。
(2)未按規(guī)程執(zhí)行檢驗。
如未按規(guī)定頻次實施檢測�;未按規(guī)定數量進行測試。
8.4.2 檢驗記錄應當包括進貨檢驗����、過程檢驗和成品檢驗的檢驗記錄、檢驗報告或證書等����。
(3)檢驗記錄信息不完整,不滿足可追溯要求�。
如未記錄檢驗設備編號;未記錄樣本信息�;未記錄樣本配制過程;未記錄原始檢測數據����。
8.7.1應當建立校準品、參考品量值溯源程序�����。對每批生產的校準品����、參考品進行賦值�。
(4)未制定企業(yè)參考品�、工作校準品量值溯源程序;配制記錄與規(guī)程不完全一致���;配制記錄不完整�����、缺失���,不滿足可追溯要求。
如未記錄賦值用試劑的批號信息�、未記錄國家參考品稀釋度;制備用臨床樣本無法有效追溯�。
醫(yī)療器械質量體系管理是實現對醫(yī)療器械生產全過程控制,保障醫(yī)療器械安全有效的重要手段��。通過對現場核查常見不符合項的匯總分析�,建議企業(yè)在日常質量體系運行過程中,應確保各階段程序受控�、分工職責明確���、過程完整���、內容真實�、記錄可追溯�,落實產品質量主體責任。
如有上海市第二類體外診斷試劑注冊咨詢服務需求�,歡迎您隨時方便與杭州證標客醫(yī)藥技術咨詢有限公司聯絡,聯系人:葉工���,電話:18058734169�,微信同�。