醫(yī)療器械臨床試驗是指:獲得醫(yī)療器械臨床試驗資格的醫(yī)療機構(gòu)對申請注冊的醫(yī)療器械在正常使用條件下的安全性和有效性按照規(guī)定進行試用或驗證的過程。醫(yī)療器械臨床試驗的目的是評價受試產(chǎn)品是否具有預(yù)期的安全性和有效性 ��。
引言:醫(yī)療器械臨床試驗是對申辦方申請注冊的醫(yī)療器械臨床試用或驗證的過程���。那么�����,醫(yī)療器械臨床試驗執(zhí)行流程是什么?以下是醫(yī)療器械臨床試驗的官方介紹��。

一�、醫(yī)療器械臨床試驗定義
在具備相應(yīng)條件的臨床試驗機構(gòu)中, 對擬申請注冊的醫(yī)療器械在正常使用條件下的安全有效性進行確認的過程。
二��、醫(yī)療器械臨床試驗前的準(zhǔn)備
預(yù)期的受益應(yīng)當(dāng)大于可能出現(xiàn)的損害�。
完成醫(yī)療器械臨床前研究。
準(zhǔn)備充足的試驗用醫(yī)療器械��。
醫(yī)療器械臨床試驗應(yīng)當(dāng)在兩個或兩個以上醫(yī)療器械臨床試驗機構(gòu)中進行���。
申辦者與臨床試驗機構(gòu)和研究者達成書面協(xié)議�����。
列入需進行臨床試驗審批的第三類醫(yī)療器械目錄產(chǎn)品的臨床試驗需獲得批準(zhǔn)���。
申辦者應(yīng)向所在省、自治區(qū)����、直轄市食品藥品監(jiān)督管理部門備案。
三�、醫(yī)療器械臨床試驗方案
申辦者應(yīng)按試驗用醫(yī)療器械的類別、風(fēng)險�����、預(yù)期用途等組織制定臨床試驗方案。
臨床試驗方案設(shè)計時應(yīng)先進行小樣本可行性試驗����。
臨床試驗方案應(yīng)包括:
1. 一般信息
2. 臨床試驗的背景資料
3. 試驗?zāi)康?/span>
4. 試驗設(shè)計交
5. 安全性評價方法
6. 有效性評價方法
具體內(nèi)容詳見《醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范》
四、注冊申報需要提交哪些資料�?
倫理委員會意見
臨床試驗方案
臨床試驗報告
具體內(nèi)容詳見《醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則》
五、醫(yī)療器械臨床試驗審批
1. 臨床試驗審批定義
對人體具有較高風(fēng)險的第三類醫(yī)療器械進行臨床試驗應(yīng)獲得國務(wù)院藥品監(jiān)督管理部門批準(zhǔn)��。
2. 需進行臨床試驗審批的第三類醫(yī)療器械目錄
國家食品藥品監(jiān)督管理總局關(guān)于發(fā)布需進行臨床試驗審批的第三類醫(yī)療器械目錄的通告(2014年第14號)
3. 臨床試驗審批流程
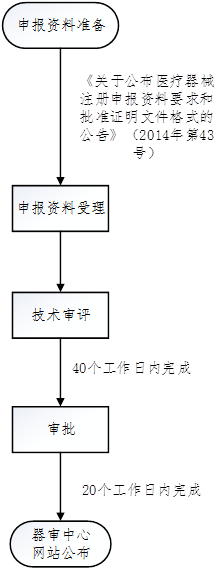
六�����、TIPS
臨床試驗審批改為默許制:自臨床試驗審批申請受理并繳費之日起60個工作日內(nèi)���,申請人在預(yù)留聯(lián)系方式�����、郵寄地址有效的前提下��,未收到器審中心意見(包括專家咨詢會議通知和補充資料通知)的���,可以開展臨床試驗。
多中心臨床試驗需按照統(tǒng)一試驗方案在不同臨床試驗機構(gòu)中同期進行
相關(guān)法規(guī)
關(guān)于調(diào)整醫(yī)療器械臨床試驗審批程序的公告(2019年 第26號)
關(guān)于公布醫(yī)療器械注冊申報資料要求和批準(zhǔn)證明文件格式的公告(2014年第43號)
醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范(國家食品藥品監(jiān)督管理總局 中華人民共和國國家衛(wèi)生和計劃生育委員會令第25號)
醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則(2015年第14號)
醫(yī)療器械臨床試驗設(shè)計指導(dǎo)原則(2018年第6號)
國家食品藥品監(jiān)督管理總局關(guān)于發(fā)布需進行臨床試驗審批的第三類醫(yī)療器械目錄的通告(2014年第14號)
無源植入性醫(yī)療器械臨床試驗審批申報資料編寫指導(dǎo)原則(2018年第40號)
總局關(guān)于需審批的醫(yī)療器械臨床試驗申請溝通交流有關(guān)事項的通告(2017年第184號)
第三類高風(fēng)險醫(yī)療器械臨床試驗審批服務(wù)指南