《醫(yī)療器械注冊(cè)與備案管理辦法》(國(guó)家市場(chǎng)監(jiān)督管理總局令第47號(hào))第八條:第一類醫(yī)療器械實(shí)行備案管理����,第二類、第三類醫(yī)療器械實(shí)行注冊(cè)管理�。境內(nèi)第二類醫(yī)療器械由省、自治區(qū)��、直轄市食品藥品監(jiān)督管理部門(mén)審查�����,批準(zhǔn)后發(fā)給醫(yī)療器械注冊(cè)證�����。本文為大家介紹云南第二類醫(yī)療器械注冊(cè)流程�����、時(shí)間和申報(bào)資料要求�。
引言:《醫(yī)療器械監(jiān)督管理?xiàng)l例》(國(guó)務(wù)院令第739號(hào))第十三條:第一類醫(yī)療器械實(shí)行產(chǎn)品備案管理,第二類���、第三類醫(yī)療器械實(shí)行產(chǎn)品注冊(cè)管理�。第十六條:申請(qǐng)第二類體外診斷試劑產(chǎn)品注冊(cè),注冊(cè)申請(qǐng)人應(yīng)當(dāng)向所在地省��、自治區(qū)��、直轄市人民政府食品藥品監(jiān)督管理部門(mén)提交注冊(cè)申請(qǐng)資料��。 《醫(yī)療器械注冊(cè)與備案管理辦法》(國(guó)家市場(chǎng)監(jiān)督管理總局令第47號(hào))第八條:第一類醫(yī)療器械實(shí)行備案管理�����,第二類�、第三類醫(yī)療器械實(shí)行注冊(cè)管理。境內(nèi)第二類醫(yī)療器械由省��、自治區(qū)����、直轄市食品藥品監(jiān)督管理部門(mén)審查,批準(zhǔn)后發(fā)給醫(yī)療器械注冊(cè)證����。本文為大家介紹云南第二類醫(yī)療器械注冊(cè)流程、時(shí)間和申報(bào)資料要求��。
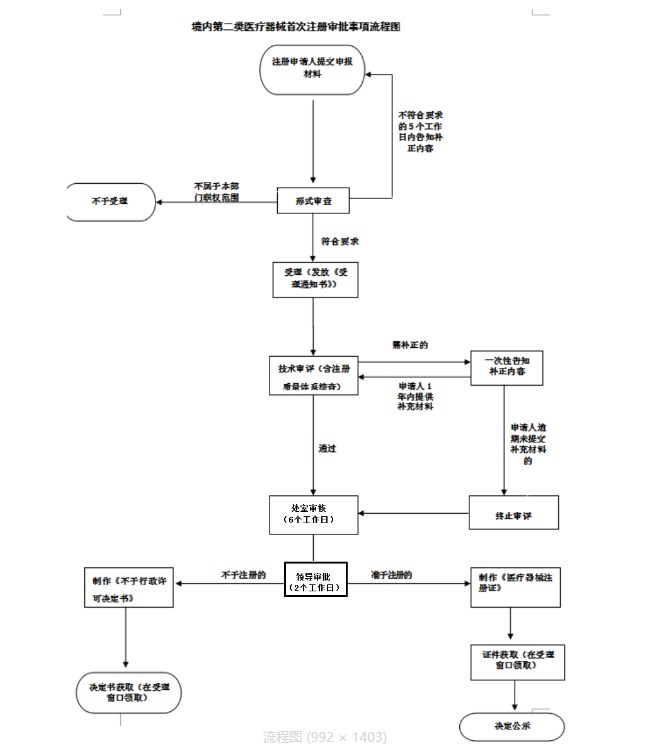
一���、云南第二類醫(yī)療器械注冊(cè)流程:
云南第二類醫(yī)療器械注冊(cè)流程與其他省市基本一致��,包括企業(yè)前期準(zhǔn)備�、醫(yī)療器械質(zhì)量管理體系建設(shè)�����、產(chǎn)品研發(fā)定型����、制造與質(zhì)量保證能力具備、醫(yī)療器械注冊(cè)檢驗(yàn)��、醫(yī)療器械注冊(cè)申請(qǐng)���、省藥監(jiān)局技術(shù)審評(píng)和注冊(cè)質(zhì)量管理體系考核�、補(bǔ)正����、獲得醫(yī)療器械注冊(cè)證、申請(qǐng)醫(yī)療器械生產(chǎn)許可證這些關(guān)鍵事項(xiàng)�。
藥監(jiān)局醫(yī)療器械注冊(cè)審評(píng)審批流程如下:

云南第二類醫(yī)療器械注冊(cè)流程圖如下:
二、云南第二類醫(yī)療器械注冊(cè)時(shí)間
昨日與云南省醫(yī)療器械注冊(cè)審評(píng)審批領(lǐng)導(dǎo)交流���,云南省藥監(jiān)局于2022年推出加快云南醫(yī)藥審批20條����,致力于優(yōu)化醫(yī)療器械注冊(cè)審評(píng)審批流程,提高云南第二類醫(yī)療器械注冊(cè)審評(píng)審批效率�。
盡管不同產(chǎn)品對(duì)應(yīng)的醫(yī)療器械注冊(cè)時(shí)間存在較大差異,但是主管領(lǐng)導(dǎo)的努力��,及企業(yè)和第三方醫(yī)療器械注冊(cè)服務(wù)機(jī)構(gòu)的專業(yè)度����,將幫助企業(yè)縮短產(chǎn)品注冊(cè)時(shí)間,提高醫(yī)療器械注冊(cè)上市效率�����。
三��、云南第二類醫(yī)療器械注冊(cè)申報(bào)資料要求
云南第二類醫(yī)療器械注冊(cè)申報(bào)資料主要包括如下:
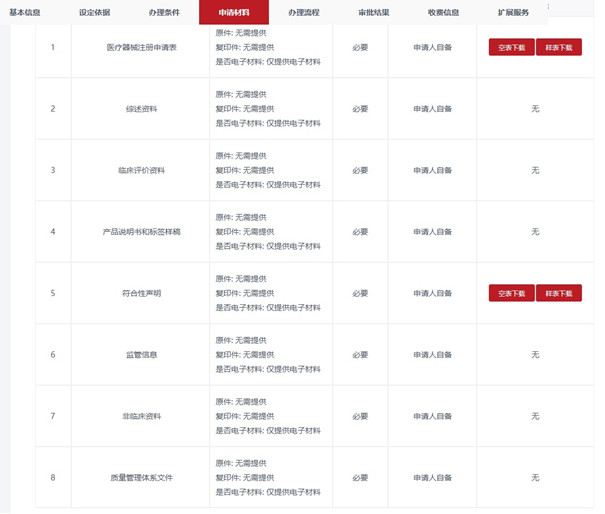
但考慮到國(guó)家局2022年開(kāi)始推行新的醫(yī)療器械注冊(cè)申報(bào)資料要求及文件目錄結(jié)構(gòu)����,預(yù)計(jì)云南第二類醫(yī)療器械注冊(cè)申報(bào)資料在不久的將來(lái)會(huì)與其它省市趨于一致。
更多有關(guān)云南第二類醫(yī)療器械注冊(cè)服務(wù)需求�����,歡迎您隨時(shí)方便與杭州證標(biāo)客醫(yī)藥技術(shù)咨詢有限公司聯(lián)絡(luò)。聯(lián)系人:葉工��,電話:18058734169����,微信同��。