生物材料在疾病治療和醫(yī)療保健中發(fā)揮了重要的作用,按材料性質(zhì)���,生物材料可分為惰性材料與可降解性材料兩種����,目前生物材料的發(fā)展呈現(xiàn)出由惰性向可降解性(水解和酶降解)轉(zhuǎn)變的趨勢(shì)����,這表明現(xiàn)在許多發(fā)揮臨時(shí)治療作用(幫助機(jī)體修復(fù)或再生受損組織)的生物惰性器械將被可降解材料的醫(yī)療器械替代。
生物材料在疾病治療和醫(yī)療保健中發(fā)揮了重要的作用�,按材料性質(zhì),生物材料可分為惰性材料與可降解性材料兩種����,目前生物材料的發(fā)展呈現(xiàn)出由惰性向可降解性(水解和酶降解)轉(zhuǎn)變的趨勢(shì)�,這表明現(xiàn)在許多發(fā)揮臨時(shí)治療作用(幫助機(jī)體修復(fù)或再生受損組織)的生物惰性器械將被可降解材料器械替代����。與惰性材料相比�,可降解高分子材料是一種更為理想的醫(yī)療器械材料,惰性器械普遍存在長(zhǎng)期相容性差和需要二次手術(shù)的問(wèn)題��,而可降解高分子材料器械不存在這些缺陷�。20世紀(jì)60年代后期,人工合成的可降解高分子材料開(kāi)始應(yīng)用于臨床����,最近20年生物醫(yī)學(xué)中出現(xiàn)了一些新的醫(yī)療技術(shù),包括組織工程�����,藥物控釋?zhuān)偕t(yī)學(xué)�����,基因治療和生物納米技術(shù)等�����,這些新的醫(yī)療技術(shù)都需要可降解高分子材料作支撐,它們也相應(yīng)地促進(jìn)了可降解高分子材料的發(fā)展����。
可降解高分子材料在整個(gè)降解過(guò)程中都需要具有良好的相容性,主要包括以下幾點(diǎn):
植入人體后不引起持續(xù)的炎癥或毒性反應(yīng)���;
合適的降解周期����;
在降解過(guò)程中���,具有與治療或組織再生功能相對(duì)應(yīng)的的力學(xué)性能����;
降解產(chǎn)物是無(wú)毒的�����,能夠通過(guò)代謝或滲透排出體外�;
可加工性。影響可降解高分子材料生物相容性的因素很多����,材料本身的一些性能�����,如植入物的形狀與結(jié)構(gòu)����、親水親油性�、吸水率��、表面能�����、分子量和降解機(jī)理等都需要考慮�����。
醫(yī)用高分子材料有很多種���,它們具有各自的特性����,用于滿(mǎn)足特定的臨床需求�����,目前還不存在一種理想的通用型醫(yī)用高分子材料。現(xiàn)在主要通過(guò)設(shè)計(jì)合成具有特定功能的醫(yī)用高分子材料來(lái)滿(mǎn)足不同應(yīng)用的需求����,主要包括以下3種方式:
設(shè)計(jì)合成具有獨(dú)特官能團(tuán)的高分子材料;
生物合成具有仿生結(jié)構(gòu)的高分子材料��;
使用組合計(jì)算的方法設(shè)計(jì)新型可降解高分子材料�。
小編按種類(lèi)綜述了目前常用的可降解高分子材料的性能和降解特性,以及其在醫(yī)療器械上的應(yīng)用��,包括短期植入物���、藥物運(yùn)輸載體和組織工程支架等����。
聚乙交酯(PGA)
PGA是最早應(yīng)用于臨床醫(yī)學(xué)的合成可降解高分子材料���,其具有很高的結(jié)晶度(45%~55%)���,高結(jié)晶度使它具有很大的拉伸彈性模量。PGA難溶于有機(jī)溶劑,玻璃化轉(zhuǎn)變溫度(Tg)在35~40℃之間���,熔點(diǎn)(Tm)高于200℃���,可以通過(guò)擠出、注塑和模壓等方式加工成型�����、���。由于具有良好的成纖性,PGA最早被開(kāi)發(fā)成可吸收的縫合線(xiàn)����。1969年,美國(guó)FDA批準(zhǔn)上市的第一款合成可降解縫合線(xiàn)DEXON就是由PGA制成����。因?yàn)镻GA具有合適的降解性、優(yōu)良的初始力學(xué)性能和生物活性��,PGA無(wú)紡布作為組織再生支架材料被廣泛研究�,目前一種包含PGA無(wú)紡布的支架材料正用于臨床試驗(yàn)。另外PGA硬腦膜替代品也在研究中,因?yàn)樗哂袔椭M織再生和在無(wú)縫合線(xiàn)下閉合皮膚的能力�����。PGA的高結(jié)晶度使它具有優(yōu)良的力學(xué)性能���,在臨床上使用的可降解高分子材料中�����,自增強(qiáng)PGA是最硬的�,它的模量接近12.5GPa�����、��。因?yàn)榱己玫某跏剂W(xué)性能�����,PGA也被開(kāi)發(fā)為內(nèi)固定系統(tǒng)(Biofix)�����。PGA通過(guò)鏈段中酯鍵的隨機(jī)斷裂(水解作用)實(shí)現(xiàn)降解。在水解作用下���,PGA在1~2月內(nèi)發(fā)生力學(xué)性能下降現(xiàn)象�,6~12月內(nèi)發(fā)生質(zhì)量損失現(xiàn)象����。在體內(nèi),PGA降解成甘氨酸����,甘氨酸可以通過(guò)尿液直接排出體外或代謝成CO2和H2O。高降解速率����、降解產(chǎn)物呈酸性和難溶性限制了PGA在生物醫(yī)學(xué)中的應(yīng)用,不過(guò)這些缺點(diǎn)可以通過(guò)與其它單體共聚克服�。
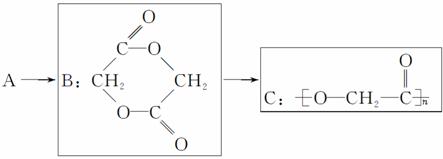
聚乳酸(PLA)
丙交酯(LA)是手性分子�,存在兩種立體異構(gòu)體:左旋LA(L–LA)和右旋LA(D–LA),它們的均聚物都是半結(jié)晶的����。外消旋LA(DL–LA)則是L–LA和D–LA的混合物,其聚合物是無(wú)規(guī)的��。聚L–LA(PLLA)的結(jié)晶度(0%~37%)由分子量和加工參數(shù)決定,其Tg為60~65℃��,Tm約為175℃�。因?yàn)樗挠H水性比PGA差,所以它的降解速率比PGA低�。PLLA具有高拉伸強(qiáng)度、低斷裂伸長(zhǎng)率和高拉伸彈性模量(接近4.8GPa)�,是理想的醫(yī)用承重材料,如骨固定器械?,F(xiàn)在市場(chǎng)上的PLLA骨固定器械有BioScrew,Bio-Anchor���,MeniscalStinger等����。另外����,PLLA也可制成高強(qiáng)度的手術(shù)縫合線(xiàn)。1971年��,PLLA手術(shù)縫合線(xiàn)經(jīng)美國(guó)FDA批準(zhǔn)上市�,它具有比DEXON更加優(yōu)良的性能。PLLA也可用于其它一些醫(yī)療領(lǐng)域����,如韌帶修復(fù)與重建����、藥物洗脫支架����、靶向藥物運(yùn)輸?shù)取?007年,美國(guó)FDA批準(zhǔn)了一種可注射的PLLA制品(Sculptra)�����,用于治療人類(lèi)免疫缺陷病毒(HIV)引起的面部脂肪損失或萎縮�����。PLLA的降解速率緩慢�����,高分子量的PLLA在體內(nèi)完全降解需要2~5.6a的時(shí)間����,結(jié)晶度和孔隙度等因素可以影響它的降解速率���。在水解作用下�,PLLA在6個(gè)月內(nèi)出現(xiàn)力學(xué)性能下降現(xiàn)象,但要經(jīng)過(guò)很長(zhǎng)的時(shí)間后才會(huì)出現(xiàn)質(zhì)量損失現(xiàn)象��。因此����,為了獲得更好的降解性能,研究者將L–LA與GA或DL–LA共聚��。ResomerLR708便是一種由L–LA與DL–LA(質(zhì)量比70∶30)共聚得到的無(wú)規(guī)共聚物�。PDLLA因?yàn)長(zhǎng)–LA和D–LA的隨機(jī)分布形成了無(wú)規(guī)共聚物,Tg在55~60℃之間�����,強(qiáng)度大幅下降��,這是由分子鏈的無(wú)規(guī)排列造成的���。在水解作用下�,PDLLA在1~2個(gè)月內(nèi)出現(xiàn)力學(xué)性能下降現(xiàn)象����,在12~16個(gè)月內(nèi)出現(xiàn)質(zhì)量損失現(xiàn)象����。與PLLA相比�,PDLLA具有低強(qiáng)度和高降解速率的特點(diǎn),是藥物運(yùn)輸載體和組織再生支架(低強(qiáng)度)的理想材料�����。PLA通過(guò)鏈段中酯鍵的隨機(jī)斷裂(水解作用)實(shí)現(xiàn)降解�,初級(jí)降解產(chǎn)物為乳酸,乳酸為人體正常代謝的副產(chǎn)物��,通過(guò)檸檬酸循環(huán)�,乳酸可進(jìn)一步降解為CO2和H2O。

共聚物(PLGA)
研究發(fā)現(xiàn)��,LA與GA的質(zhì)量比在25/75~75/25時(shí)����,PLGA為無(wú)規(guī)共聚物,R.A.Miller等的研究表明��,LA與GA的質(zhì)量比為50/50的PLGA具有最快的降解速度����。
不同單體質(zhì)量比的PLGA已經(jīng)廣泛應(yīng)用于臨床。商品名為PurasorbPLG的PLGA便是一種半結(jié)晶共聚物����,其中LA與GA質(zhì)量比為80/20;多股縫合線(xiàn)Vicryl中L–LA與GA的質(zhì)量比為10/90����,它的升級(jí)版VicrylRapid也已經(jīng)上市,經(jīng)過(guò)輻照后的升級(jí)版降解速度更快�����;
PANACRYL是另一種商業(yè)化的PLGA縫合線(xiàn)��。另外PLGA也應(yīng)用于其它醫(yī)療方面�,如網(wǎng)絲(VicrylMesh)、植皮材料和硬腦膜替代品等�����,組織工程植皮便是使用了VicrylMesh作為支架材料��。PLGA中的酯鍵因水解作用斷裂���,其降解速率受很多因素影響�����,如:LA與GA質(zhì)量比����、分子量、材料的形狀和結(jié)構(gòu)等�。PLGA具有易于加工和降解速率可控的特點(diǎn),被美國(guó)FDA批準(zhǔn)可應(yīng)用于人體�����,在可控藥物/蛋白運(yùn)輸系統(tǒng)��、組織工程支架等領(lǐng)域得到廣泛研究��。PLGA具有促進(jìn)細(xì)胞吸附和增殖作用�����,該性質(zhì)使它具有潛在的組織工程應(yīng)用���,很多研究已經(jīng)制備了微米–納米級(jí)PLGA三維支架��。圖1列出了不同方法得到的3種PLGA結(jié)構(gòu)��。
PLGA另外的一個(gè)重要應(yīng)用是藥物載體和靶向釋放��,PLGA能夠以微球��、微囊����、納米球和納米纖維等多種形式存在��,藥物的釋放參數(shù)可以通過(guò)調(diào)節(jié)PLGA的性能加以控制����。因PLGA是整體侵蝕降解,即表面和內(nèi)部同時(shí)降解����,所以它很難達(dá)到零級(jí)釋放的效果。
聚己內(nèi)酯(PCL)
PCL是一種半結(jié)晶線(xiàn)性聚酯����,由相對(duì)便宜的單體ε-己內(nèi)酯(ε-CL)直接通過(guò)開(kāi)環(huán)聚合得到。PCL的可加工性好�����,易溶于很多有機(jī)溶劑,具有較低的Tm(55~60℃)和Tg(–60℃)����。PCL的拉伸強(qiáng)度很低(23MPa),斷裂伸長(zhǎng)率很高(700%)����。另外,它還可與多種高分子共聚�����。PCL的降解周期為2~3a�,常被作為長(zhǎng)期藥物控釋載體,其中微米–納米級(jí)PCL藥物運(yùn)輸載體正處于研究階段���。PCL也被用于組織工程支架材料���,H.Tseng等采用3種不同的方法增加PCL的親水性,之后與聚乙二醇(PEG)共混制成各向異性水凝膠纖維支架���,該支架具有良好的生物相容性和可控性的結(jié)構(gòu)�����,是一種潛在的心臟瓣膜組織工程支架材料����。ZhaoJing等制備了PCL–PEG共聚物的膠束狀納米粒子,該粒子可作為苦鬼臼脂素(抗癌藥物)的運(yùn)輸載體���,在體外(37℃)及磷酸鹽緩沖液(PBS�,PH=7.4)中���,96h可釋放70%的藥物,與Higuchi方程十分吻合�,因而含有PPP的PCL–PEG共聚物納米微粒有望成為注射制劑。因?yàn)镻CL的降解速率很慢�����,為了獲得較快的降解速率�����,研究者已經(jīng)開(kāi)發(fā)了幾類(lèi)含有PCL的共聚物����。將ε-CL與DL-LA共聚可獲得更快的降解速率����,同樣��,ε-CL還可與GA共聚制成手術(shù)縫合線(xiàn)����,它的硬度比PGA小,單絲縫合線(xiàn)MONACRYL便是這樣的一款產(chǎn)品��。另外由ε-CL�����,LA�,GA和PEG組成的多嵌段共聚物可應(yīng)用于藥物控釋系統(tǒng),它主要作為中小型生物活性分子的載體(SynBiosys)�����,B.J.Hong等發(fā)現(xiàn)了一種制備PCL基小干擾RNA(siRNA)載體的方法�����,制備過(guò)程簡(jiǎn)單便利,它對(duì)腫瘤細(xì)胞增殖有明顯的抑制作用��。
聚二惡烷酮(PDS)
雖然PLA和PGA可制成通用型可降解多絲縫合線(xiàn)�����,但多絲縫合線(xiàn)在使用中存在高的感染風(fēng)險(xiǎn)�����,在穿透組織時(shí)多絲縫合線(xiàn)也存在較大的摩擦力�����,故很多研究者在尋找適合制成單絲縫合線(xiàn)的高分子材料��。PDS便是一種適合制成單絲縫合線(xiàn)的可降解高分子材料�����,在20世紀(jì)80年代����,第一款PDS單絲縫合線(xiàn)PDS上市���。另外�����,PDS固定螺釘(OrthosorbAbsorbablePins)也被應(yīng)用于骨科�,它主要用于小骨及軟骨的固定與修復(fù)。PDS是無(wú)色半結(jié)晶高分子����,它可由p-二惡烷酮開(kāi)環(huán)聚合得到,Tg為–10~0℃���。作為聚酯的一員��,它的降解也是通過(guò)鏈中酯鍵的隨機(jī)斷裂實(shí)現(xiàn)���。高結(jié)晶度和親水性使PDS具有適中的降解速率。在體內(nèi)��,PDS降解為乙醛酸��,可通過(guò)尿液排出體外���,也可進(jìn)一步降解為甘氨酸�,與GA降解產(chǎn)物一致。和PGA相比���,PDS的拉伸彈性模量(接近1.5GPa)很低���。在水解作用下,PDS在1~2內(nèi)發(fā)生力學(xué)性能下降現(xiàn)象����,6~12月內(nèi)發(fā)生質(zhì)量損失現(xiàn)象。
聚羥基脂肪酸酯(PHA)
PHA類(lèi)可降解高分子材料包括聚3-羥基丁酸酯(PHB)�����,聚4-羥基丁酸酯(P4HB)�����,PHB與聚3-羥基戊酸酯的共聚物(PHBV)等��,其中���,PHB的應(yīng)用最為廣泛。1920年��,研究者首次發(fā)現(xiàn)巨大芽孢桿菌可產(chǎn)生PHB。此后����,研究發(fā)現(xiàn)其它幾種菌株也可產(chǎn)生PHB。PHB是一種半結(jié)晶的全同(立構(gòu))聚合物�,熔點(diǎn)在160~180℃之間。PHB的降解屬于表面侵蝕降解����,異于常見(jiàn)的整體侵蝕降解。除了細(xì)菌制備的方法����,研究者也開(kāi)發(fā)出了化學(xué)合成的工藝,B.Panchal等通過(guò)開(kāi)環(huán)聚合反應(yīng)��,由單體β-丁內(nèi)酯制備了PHB��,它與細(xì)菌制得的PHB是等同的��。3-羥基丁酸酯(HB)與3-羥基戊酸(HA)的共聚物P(HB–HV)具有與PHB相似的半結(jié)晶結(jié)構(gòu)��,它的Tg為–5~20℃����,隨HV含量的不同�����,P(HB–HV)的Tm下降幅度也不同�����。PHB和P(HB–HV)易溶于有機(jī)溶劑����,容易加工成各種形狀和結(jié)構(gòu)的制品�,因P(HB–HV)易碎性減弱,它更適合用于生物材料�����。另外P(HB–HV)具有壓電的特性���,這一特性使它可應(yīng)用于骨科���,因電刺激能促進(jìn)骨愈合。PHB作為藥物運(yùn)輸載體時(shí)可達(dá)到零級(jí)釋放的效果���,但它的降解周期較長(zhǎng)�����。為了改善它的降解性能��,研究者常將它與親水性物質(zhì)共聚����,一般為PEG�����。A.V.Murueva等制備了PHA系列微球作為藥物運(yùn)輸載體��,微球載藥量對(duì)微球大小和ζ電位都有影響��,載藥后ζ電位減小��,微球平均直徑變大��,制備的PHA系列微球具有優(yōu)良的生物相容性����。PHA類(lèi)可降解高分子材料具有抗感染方面的潛在用途,研究表明PHA藥物運(yùn)輸系統(tǒng)在感染部位能夠提供和維持合適的抗生素溶度。PHA已經(jīng)廣泛應(yīng)用于醫(yī)療器械���、心血管組織工程��、神經(jīng)導(dǎo)管組織工程���、骨組織工程、軟骨組織工程����、藥物運(yùn)輸載體和醫(yī)療保健。
聚三亞甲基碳酸酯(PTMC)
PTMC是一種脂肪族聚酯彈性體����,它的力學(xué)強(qiáng)度不高,通常作為軟組織再生支架或藥物運(yùn)輸載體����。PTMC在體內(nèi)外的降解速率差別很大,其在磷酸鹽緩沖液(pH=7.4)中2a內(nèi)不發(fā)生降解���,但將其植入鼠背部皮下中�����,很快就發(fā)生降解�����,主要表現(xiàn)為PTMC的形狀發(fā)生了變化����,但其分子量并沒(méi)有發(fā)生改變�����,這表明PTMC在體內(nèi)發(fā)生了表面侵蝕降解��。不同分子量的PTMC具有不同的降解速率�,高分子量PTMC的降解速率比低分子量PTMC的要快得多,這可能是因?yàn)榈头肿恿縋TMC親水性好一些�,親水性的表面使脂肪分解酵素活性降低,降解速率減慢����。ZengNi等制備了PTMC屏障薄膜,用于口腔頜面外科手術(shù)中引導(dǎo)骨再生��,與膠原蛋白薄膜相比����,PTMC膜可誘導(dǎo)生成較多的骨組織����。JiangXinyi等為了提高藥物對(duì)血腦屏障的穿透和改善藥物在神經(jīng)膠質(zhì)瘤細(xì)胞中的濃度�,制備了2-脫氧-D-葡萄糖改性的PEG–PTMC共聚物納米微粒,該微粒具有均勻分布的理想尺寸(71nm)�����、較高的包封率和適當(dāng)?shù)淖仙即钾?fù)載量��,體外和體內(nèi)試驗(yàn)表明該微粒具有優(yōu)良的血腦屏障穿透能力和對(duì)顱內(nèi)腫瘤細(xì)胞的靶向作用����。PTMC的力學(xué)性能較差,研究者多將它與其它線(xiàn)性?xún)?nèi)酯共聚以改善它的力學(xué)性能�����,不過(guò)PTMC及其共聚物均具有良好的降解性和生物相容性�����。R.A.Wach等制備了PLLA–三亞甲基碳酸酯(TMC)共聚物與甲基纖維素(MC)混合多孔性導(dǎo)管支架���,其中MC作為生物活性物質(zhì)(如生長(zhǎng)因子)的載體�����。理化性能和毒性測(cè)試結(jié)果表明����,該導(dǎo)管非常適合用于神經(jīng)導(dǎo)管再生��,該導(dǎo)管可用于損傷后外周神經(jīng)系統(tǒng)的再生��。GA和TMC的共聚物已經(jīng)被開(kāi)發(fā)為柔性縫合線(xiàn)(Maxon)和骨科固定器械(Acufex)��,另外將GA���,TMC和二氧雜環(huán)乙烷共聚可制得低剛性的共聚物�,降解周期3~4個(gè)月��,可用于制作縫合線(xiàn)(BioSyn)���。
聚氨酯(PUR)和聚醚氨酯(PEU)
不可降解PUR和PEU具有良好的生物相容性和力學(xué)性能�,可用于制作長(zhǎng)期醫(yī)學(xué)植入物��,如心臟起搏器、人工血管等�����。因不可降解PUR具有良好的生物學(xué)性能和多樣性的合成途徑�,研究者開(kāi)始嘗試發(fā)展可降解PUR。PUR一般通過(guò)二異氰酸酯與二醇/二胺的縮聚反應(yīng)制備�,但是常見(jiàn)的二異氰酸酯,如4�����,4'-二苯基甲烷二異氰酸酯(MDI)��、甲苯-2�,4-二異氰酸酯(TDI)等毒性太大,故研究者開(kāi)發(fā)其它脂肪族二異氰酸酯[如1����,4-丁烷二異氰酸酯(BDI)、六亞甲基二異氰酸酯(HDI)���、琥珀酰氯(LDI)��、異佛爾酮二異氰酸酯(IPDI)和賴(lài)氨酸三異氰酸酯等]來(lái)合成可降解PUR����。LDI與DL–LA,CL及其它單體反應(yīng)可制備降解PEU���,它的性能可以在很大范圍內(nèi)進(jìn)行調(diào)節(jié)��。在這些PEU中����,脂肪族聚酯構(gòu)成軟段����,多肽構(gòu)成硬段�����。J.Podporska-Carroll等利用相逆轉(zhuǎn)技術(shù)制備了聚(酯-氨酯)脲(PEUU)三維多孔支架���,將人骨肉瘤MG–63細(xì)胞接種到支架中培養(yǎng)4周����,結(jié)果表明該支架具有支持細(xì)胞吸附�����,生長(zhǎng)和增殖的作用,是一種潛在的松質(zhì)骨替代品����。J.R.Martin等制備了選擇性降解的聚硫縮酮氨酯(PTK–UR)組織工程支架,它可被細(xì)胞產(chǎn)生的活性氧(ROS)選擇性降解���,從而實(shí)現(xiàn)組織生長(zhǎng)和材料降解之間的協(xié)調(diào)���,ROS是調(diào)節(jié)細(xì)胞功能的關(guān)鍵介質(zhì),特別是在炎癥和組織愈合部位��,機(jī)體對(duì)植入物的自然反應(yīng)便是產(chǎn)生炎癥和ROS����。另外研究者也制備了對(duì)PH敏感的PUR,它可以自組裝形成膠束���,有望成為多功能活性細(xì)胞內(nèi)藥物運(yùn)輸載體�。在組織工程中���,研究者正在開(kāi)發(fā)PEU(Degrapol)作為支架材料���;在骨科中�����,研究者開(kāi)發(fā)出了一種可注射的雙組分PUR(PolyNova)�,它以液體的形態(tài)在關(guān)節(jié)鏡下使用����,在原位中體溫下聚合后提供合適的連接和支撐力,展現(xiàn)出來(lái)的性能等同或優(yōu)于常用的骨水泥���,另外它還可以促進(jìn)細(xì)胞粘附和增殖�����。