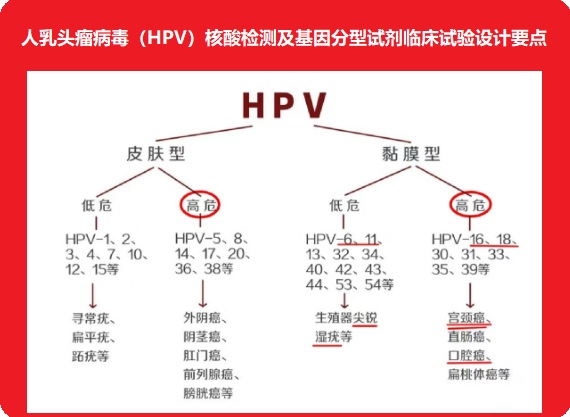
人乳頭瘤病毒(HPV)核酸檢測及基因分型試劑是指利用包括PCR-熒光探針法或其他分子生物學(xué)方法在內(nèi)的核酸檢測技術(shù)����,以特定高危型HPV核酸(包括DNA和RNA)序列為檢測目的,對人宮頸脫落上皮細胞進行體外定性檢測的試劑�����,以確定受試樣本中是否存在高于陽性判斷值水平的高危型HPV病毒��,或同時鑒定感染HPV的基因型別���。
人乳頭瘤病毒(HPV)核酸檢測及基因分型試劑是指利用包括PCR-熒光探針法或其他分子生物學(xué)方法在內(nèi)的核酸檢測技術(shù),以特定高危型HPV核酸(包括DNA和RNA)序列為檢測目的�����,對人宮頸脫落上皮細胞進行體外定性檢測的試劑�����,以確定受試樣本中是否存在高于陽性判斷值水平的高危型HPV病毒�,或同時鑒定感染HPV的基因型別。此類試劑在臨床上用于:(1)篩查宮頸細胞學(xué)檢查為ASC-US(意義未確定的非典型鱗狀上皮細胞)結(jié)果的患者,以確定是否需要進行陰道鏡檢查(以下簡稱ASC-US人群分流用途)���;(2)對于30歲及以上的女性�����,通過檢測是否有高危型HPV感染�����,與宮頸細胞學(xué)檢查聯(lián)合進行宮頸癌篩查���,此檢測結(jié)合細胞學(xué)病史和其他風(fēng)險因素的評估、以及臨床診療和篩查指南的要求���,用于指導(dǎo)患者的管理(以下簡稱宮頸癌聯(lián)合篩查用途)���;(3)對于某年齡段(根據(jù)臨床試驗結(jié)果而定)女性,通過檢測是否有高危型HPV感染����,進行宮頸癌篩查,此檢測結(jié)合細胞學(xué)病史和其他風(fēng)險因素的評估�、以及臨床診療和篩查指南的要求�����,用于指導(dǎo)患者的管理(以下簡稱宮頸癌初篩用途)����。除此以外�,若申請人提出其他的預(yù)期用途,則應(yīng)詳細描述相關(guān)的臨床背景信息和該檢測與臨床用途的相關(guān)性����,并在臨床試驗中充分驗證相關(guān)的臨床意義。
該類試劑應(yīng)通過臨床試驗路徑進行臨床評價��,臨床試驗包括產(chǎn)品臨床性能研究和針對預(yù)期用途的臨床有效性研究兩部分�。臨床試驗應(yīng)符合《體外診斷試劑注冊與備案管理辦法》《醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范》和《體外診斷試劑臨床試驗技術(shù)指導(dǎo)原則》的要求��,如相關(guān)法規(guī)����、文件有更新,臨床試驗應(yīng)符合更新后的要求�����。下面僅說明該類產(chǎn)品臨床試驗中應(yīng)關(guān)注的重點問題。
1. HPV核酸臨床檢測性能研究設(shè)計
1.1臨床試驗方法
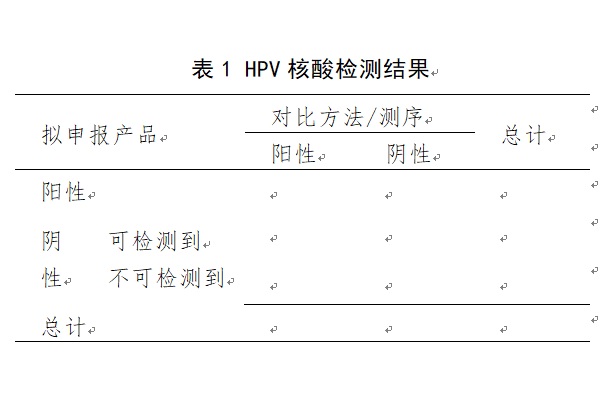
申請人應(yīng)選擇已批準上市�����、臨床普遍認為質(zhì)量較好的同類產(chǎn)品和/或核酸序列測定方法作為對比方法����,采用擬申報產(chǎn)品與之進行比較研究試驗,以評價擬申報產(chǎn)品檢測目標HPV基因型的能力����。需要注意的是,當擬申報產(chǎn)品的陽性判斷值高于最低檢測限水平時����,檢測結(jié)果判定為“陰性”的情況包括兩種,其一為待測樣本中存在高于最低檢測限水平的HPV靶核酸����,但靶核酸水平低于陽性判斷值;其二為待測樣本中無HPV靶核酸����,或靶核酸水平低于最低檢測限水平。在檢測結(jié)果的統(tǒng)計分析中應(yīng)分別列明各種情況�����,可參考表1。
1.2臨床試驗對比方法選擇
臨床試驗應(yīng)選擇已上市的同類產(chǎn)品作為對比試劑�����,評價申報產(chǎn)品與已上市同類產(chǎn)品的一致性�。對比試劑的選擇應(yīng)考慮檢測的人乳頭瘤病毒型別范圍、產(chǎn)品性能等方面應(yīng)與試驗體外診斷試劑具有良好的可比性�����。針對不區(qū)分型別的檢測試劑�����,應(yīng)采用適當?shù)姆椒ù_認納入臨床試驗的陽性病例樣本HPV型別����;針對分型檢測試劑����,對比方法應(yīng)能夠充分評價每個型別的臨床檢測性能。選擇已上市同類產(chǎn)品進行臨床試驗時�,對比試劑配套使用的核酸提取試劑應(yīng)滿足其說明書要求��。
申請人亦可采用試驗體外診斷試劑與核酸序列測定(Sanger測序)方法進行對比試驗�,評價兩種檢測方法的一致性�。同時還應(yīng)進行部分病例與已上市同類產(chǎn)品進行對比試驗。以上兩方面評價結(jié)果結(jié)合起來共同論證試驗體外診斷試劑的臨床性能���。
臨床試驗資料中應(yīng)對測序方法進行詳細的介紹�����,應(yīng)采用公認的靶基因進行測序����,針對靶基因的選擇應(yīng)提供依據(jù)�����。明確檢測過程中配套使用的核酸提取試劑���,針對測序方法提交性能驗證數(shù)據(jù)���,證明測序方法與試驗體外診斷試劑的可比性。如測序試驗委托其他機構(gòu)完成�,還應(yīng)提交由臨床試驗機構(gòu)委托第三方機構(gòu)/實驗室開展相關(guān)試驗的測序服務(wù)合同/協(xié)議���,提交相關(guān)機構(gòu)資質(zhì)和選擇依據(jù)。
有關(guān)核酸序列測定方法的資料要求:臨床試驗中如涉及核酸序列測定方法����,則建議對擴增子進行雙向測序。應(yīng)在臨床研究報告中對選用的測序方法做詳細介紹�����,并提供以下關(guān)于測序試驗的詳細信息及資料���。
1)測序方法原理��、測序儀型號���、測序試劑及消耗品的相關(guān)信息。
2)測序方法所用引物相關(guān)信息���,如基因區(qū)段選擇���,分子量�����、純度、功能性試驗等資料��。
3)對所選測序方法的分析性能進行合理驗證�,尤其是最低檢測限的確認,建議將所選測序方法與擬申報產(chǎn)品的相關(guān)性能進行適當比對分析����。
4)測序方法應(yīng)建立合理的陽性質(zhì)控品和陰性質(zhì)控品對臨床樣本的檢測結(jié)果進行質(zhì)量控制。
5)提交有代表性的樣本測序圖譜及結(jié)果分析資料���。
1.3臨床試驗受試人群的選擇及樣本采集
病例選擇及樣本類型:受試者應(yīng)包含各種臨床表現(xiàn)的人群���,如:宮頸細胞學(xué)檢查正常者、宮頸上皮細胞異常者以及診斷為宮頸上皮內(nèi)瘤變(CIN)和宮頸浸潤癌等的患者�����,受試者年齡應(yīng)在<30��、30~39�、40歲以上年齡段均有分布。
臨床試驗如選擇與已上市同類產(chǎn)品進行比對的設(shè)計��,且試驗體外診斷試劑與對比試劑由于樣本采集、處理���、保存等差異不能使用同一份樣本進行檢測�,此時可針對每位受試者進行兩次樣本采集�����,并分別進行試驗體外診斷試劑和對比試劑的檢測�����,兩次采集樣本的順序應(yīng)遵循隨機原則����。需要注意的是,臨床試驗應(yīng)保證一次樣本采集不會影響下一次樣本采集����。
1.4臨床試驗樣本量
建議以與對比方法的比較研究為基礎(chǔ)進行樣本量估算。臨床試驗陽性樣本和陰性樣本數(shù)量應(yīng)分別滿足統(tǒng)計學(xué)要求�����。針對與Sanger測序法或同類已上市產(chǎn)品的對比試驗,可采用目標值法公式分別估算整體最低陽性和陰性樣本例數(shù)����。
樣本量估算公式如下:

其中陽性符合率和陰性符合率的臨床可接受標準(P0)建議不低于90%����。臨床試驗結(jié)果中,相關(guān)評價指標的95%置信區(qū)間下限應(yīng)不低于預(yù)設(shè)的臨床可接受標準�����。當評價指標P接近100%時�,上述樣本量估算方法可能不適用,應(yīng)考慮選擇更加適宜的方法進行樣本量估算和統(tǒng)計學(xué)分析�����,如精確概率法等���。申請人亦可以選擇其他樣本量估算模型�,但應(yīng)詳述該樣本估算模型及相關(guān)參數(shù)設(shè)置的的科學(xué)性�、合理性。
臨床試驗中����,針對產(chǎn)品檢測范圍內(nèi)的每種HPV基因型均應(yīng)具有一定的陽性例數(shù)�。結(jié)合產(chǎn)品臨床性能評價需要及HPV感染陽性率�,建議16型陽性不低于100例,18型陽性不低于50例��,其他各型別����,如能夠分型,建議各型別分別不低于30例����;如不能分型,產(chǎn)品能夠涵蓋的各亞型建議分別不低于20例���。針對臨床試驗過程中確實難以收集的亞型�,在提供相關(guān)證據(jù)的前提下�,病例數(shù)可酌情減少。
鑒于此類產(chǎn)品樣本采集過程對檢測結(jié)果的準確性至關(guān)重要�����,因此���,如產(chǎn)品可采用不止一種樣本保存液����,則應(yīng)針對不同的樣本保存液進行同源樣本的比較研究試驗,證明不同的樣本保存液不會影響檢測結(jié)果�����。相關(guān)比較研究試驗應(yīng)于2家以上(含兩家)臨床試驗機構(gòu)進行����,樣本例數(shù)不少于100例�����。
1.5統(tǒng)計學(xué)分析
應(yīng)選擇合適的統(tǒng)計學(xué)方法對比較研究試驗的檢測數(shù)據(jù)進行合理分析���。對于此類試劑的比較研究試驗����,常選擇交叉四格表的形式總結(jié)兩種方法定性檢測結(jié)果���,計算陽性符合率���、陰性符合率和總符合率���,并計算95%置信區(qū)間,以考察兩種方法檢測結(jié)果的一致性�����。
對于基因分型試劑��,臨床試驗中應(yīng)分別驗證該產(chǎn)品對可鑒別HPV基因型的臨床檢測準確性��,針對不同基因型HPV分別完成如上所述的統(tǒng)計學(xué)分析���。
結(jié)果差異樣本的分析和驗證:對于兩種方法的檢測結(jié)果不一致的樣本���,申請人應(yīng)針對具體情況進行合理分析,必要時選擇其他合理的方法進行驗證���,亦可結(jié)合患者的臨床病情進行分析����。
2.預(yù)期用途的臨床有效性研究設(shè)計
2.1針對ASC-US人群分流用途
2.1.1臨床試驗方法
申請人應(yīng)在適合進行宮頸細胞學(xué)檢查的女性中��,入組宮頸細胞學(xué)檢查為ASC-US的受試者,針對入組的ASC-US人群首先采用擬申報產(chǎn)品進行HPV核酸檢測�,然后,無論HPV檢測結(jié)果如何��,均應(yīng)進行陰道鏡檢查���,根據(jù)陰道鏡檢查結(jié)果�,必要時取樣進行組織病理學(xué)檢查��。建議采用同一份宮頸上皮細胞樣本進行細胞學(xué)檢查和HPV檢測�����,以避免樣本取材不同帶來的偏差���;而宮頸細胞樣本采集與陰道鏡檢查之間的時間間隔不應(yīng)過長,建議不超過12周����。以陰道鏡檢查和組織病理學(xué)檢查結(jié)果為金標準,評價擬申報產(chǎn)品的臨床性能����。
2.1.2臨床試驗受試人群
臨床試驗入組人群應(yīng)為宮頸細胞學(xué)檢查為ASC-US的受試者����,臨床試驗建議前瞻性入組��,應(yīng)避免選取已確定需進行陰道鏡檢查的人群��,以免造成入組人群的傾向性����,臨床試驗應(yīng)以來自篩查的人群為主。入組人群應(yīng)盡量在不同的年齡范圍均有分布(<30���、30~39和40歲以上)�,各年齡組受試者例數(shù)及CIN2以上病例均應(yīng)有一定的病例數(shù)���。
2.1.3臨床試驗病例數(shù)
應(yīng)根據(jù)檢測試劑靈敏度要求�、疾病發(fā)病率等對入組樣本例數(shù)進行科學(xué)的分析和計算����,本臨床研究建議以臨床靈敏度為主要評價指標,采用抽樣精度的模型進行樣本量估算�。臨床試驗終點為病理學(xué)檢查結(jié)果≥CIN2??刹捎萌缦鹿剑?/p>
2.1.4 統(tǒng)計分析
臨床試驗結(jié)果一般以四格表的形式進行總結(jié)����,并據(jù)此計算臨床靈敏度��、臨床特異性�����、陽性預(yù)期值�、陰性預(yù)期值、陽性似然比�、陰性似然比,并采用適當?shù)姆椒ㄓ嬎?5%置信區(qū)間�;對于基因分型試劑,還需針對可鑒別的基因型單獨完成上述數(shù)據(jù)統(tǒng)計分析����,應(yīng)能夠支持基因分型的臨床意義���;數(shù)據(jù)統(tǒng)計和分析方法參見表2和表3�。
臨床試驗結(jié)果:應(yīng)通過分析靈敏度��、特異度��、陽性似然比和陰性似然比的結(jié)果判斷擬申報產(chǎn)品用于ASC-US人群分流的臨床性能是否能夠滿足臨床要求。
如有人乳頭瘤病毒(HPV)核酸檢測及基因分型試劑臨床試驗設(shè)計及數(shù)據(jù)統(tǒng)計服務(wù)需求����,歡迎您隨時方便與杭州證標客醫(yī)藥技術(shù)咨詢有限公司聯(lián)絡(luò),聯(lián)系人:葉工�����,電話:18058734169��,微信同�。