上海是長三角經(jīng)濟(jì)帶最重要城市,也是我國醫(yī)療器械注冊改革先發(fā)城市���,在醫(yī)療器械監(jiān)管管理方面一直是榜樣和示范��。本文以上海市藥監(jiān)局發(fā)布的2011年度官方數(shù)據(jù)為基礎(chǔ)���,帶大家一起看醫(yī)療器械注冊質(zhì)量管理體系考核常見不符合項(xiàng)。
引言:上海是長三角經(jīng)濟(jì)帶最重要城市����,也是我國醫(yī)療器械注冊改革先發(fā)城市,在醫(yī)療器械監(jiān)管管理方面一直是榜樣和示范����。本文以上海市藥監(jiān)局發(fā)布的2011年度官方數(shù)據(jù)為基礎(chǔ),帶大家一起看醫(yī)療器械注冊質(zhì)量管理體系考核常見不符合項(xiàng)�。
一、2021年度上海醫(yī)療器械注冊體系考核不合格項(xiàng)分布:
2021年度共完成現(xiàn)場核查909件���,累計(jì)發(fā)現(xiàn)不合項(xiàng)4648條����,平均每次核查開具不合格項(xiàng)至少5條�����。其中生產(chǎn)管理��、質(zhì)量控制��、設(shè)計(jì)開發(fā)�、采購控制四部分的不合格項(xiàng)數(shù)量占總數(shù)的77%。
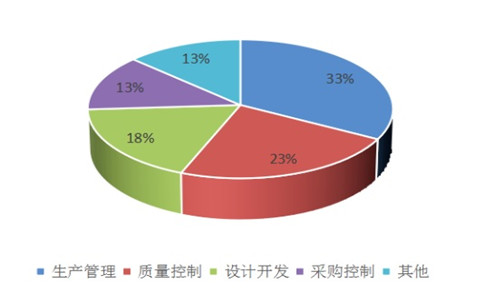
所有不符合項(xiàng)中�,一般項(xiàng)不合格數(shù)量為3095條,占比67%�,關(guān)鍵項(xiàng)(*星號項(xiàng))不合格數(shù)量為1553條,占比為33%��,說明我市醫(yī)療器械生產(chǎn)質(zhì)量管理體系運(yùn)行能力和總體情況較好�。在關(guān)鍵(*星號項(xiàng))不合格項(xiàng)中,生產(chǎn)管理占33%�����,質(zhì)量控制占23%,設(shè)計(jì)開發(fā)占18%�����,采購控制占13%�,這四部分合計(jì)占關(guān)鍵項(xiàng)總數(shù)的87%,進(jìn)一步說明這四部分是醫(yī)療器械生產(chǎn)質(zhì)量管理體系的核心和容易出現(xiàn)問題的薄弱點(diǎn)����。
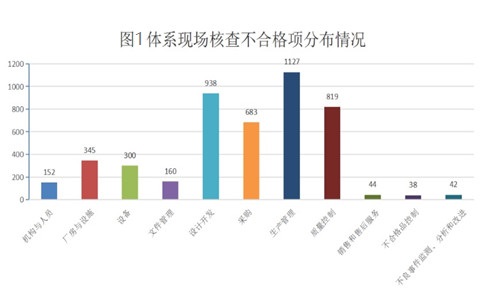
圖2.體系現(xiàn)場考核關(guān)鍵不符合項(xiàng)分布情況
從不同類別的產(chǎn)品不合格項(xiàng)數(shù)量分布的情況來看,如下圖所示��,無菌產(chǎn)品共開具不合格項(xiàng)1527條���,有源產(chǎn)品共開具不合格項(xiàng)1059條�,較其他類型產(chǎn)品顯著增加��,一方面與無菌��、有源類產(chǎn)品申報(bào)數(shù)量相對較高有關(guān)��,另一方面也說明有源產(chǎn)品部分生產(chǎn)企業(yè)質(zhì)量管理體系基礎(chǔ)比較薄弱�,運(yùn)行能力和有效性不足;無菌類產(chǎn)品復(fù)雜����,要求相對較高��,企業(yè)容易出現(xiàn)管控不到位的情況���。
二�����、醫(yī)療器械注冊質(zhì)量體系核查發(fā)現(xiàn)的主要缺陷和風(fēng)險(xiǎn):
(1)變更控制方面 在原材料供應(yīng)商或質(zhì)量標(biāo)準(zhǔn)����、產(chǎn)品結(jié)構(gòu)組成或性能指標(biāo)、生產(chǎn)方式或關(guān)鍵設(shè)備�、工藝流程、工藝參數(shù)��、性能檢測方法或條件等方面發(fā)生變更后未及時(shí)進(jìn)行風(fēng)險(xiǎn)評價(jià)�、驗(yàn)證或確認(rèn)、評審�,實(shí)質(zhì)性變更未按法定程序申請變更注冊;內(nèi)部溝通缺乏��,操作層面文件未同步更新等�,變更控制不充分����,可能導(dǎo)致上市后的違法風(fēng)險(xiǎn)�、產(chǎn)品安全和有效風(fēng)險(xiǎn)。
(2)偏差控制方面 在產(chǎn)品實(shí)現(xiàn)過程中未能有效識別偏差��,物料質(zhì)量等級或投料量�、工藝配方和參數(shù)、質(zhì)量檢驗(yàn)原始數(shù)據(jù)和方法等與質(zhì)量標(biāo)準(zhǔn)��、工藝文件���、產(chǎn)品技術(shù)要求等存在不一致的情況���,可能導(dǎo)致上市后的違法風(fēng)險(xiǎn)、產(chǎn)品安全和有效風(fēng)險(xiǎn)��。
(3)可追溯性控制方面 未明確內(nèi)部及外部可追溯范圍���、途徑����、程度��,在原料、半成品或成品的批號/編號管理�����、批記錄控制��、設(shè)備使用管理�����、倉庫出入庫管理�、檢驗(yàn)原始記錄管理等方面存在批號/編號未準(zhǔn)確記錄���、批記錄關(guān)鍵參數(shù)不完整�、關(guān)鍵設(shè)備記錄缺失����、出入庫信息不全、原始記錄不能提供���、銷售記錄不完整等問題���,不能實(shí)現(xiàn)產(chǎn)品質(zhì)量有效追溯����。
(4)委托生產(chǎn)方面 存在委托生產(chǎn)質(zhì)量協(xié)議不完整�、雙方職責(zé)分工不明確、各過程接口不清晰��、設(shè)計(jì)輸出文件轉(zhuǎn)移不全����、受托方評審不充分、發(fā)生變更未及時(shí)溝通等問題����,可能導(dǎo)致產(chǎn)品質(zhì)量安全風(fēng)險(xiǎn)。