醫(yī)療器械臨床試驗(yàn)數(shù)據(jù)遞交要求注冊(cè)審查指導(dǎo)原則
一�、前言
醫(yī)療器械臨床試驗(yàn)數(shù)據(jù)是評(píng)價(jià)醫(yī)療器械安全有效性的重要支持性資料之一�。規(guī)范地收集、整理�����、分析和遞交醫(yī)療器械臨床試驗(yàn)數(shù)據(jù)有助于提高臨床試驗(yàn)實(shí)施和管理質(zhì)量,同時(shí)有利于監(jiān)管機(jī)構(gòu)快速����、高效地掌握臨床試驗(yàn)的開展情況,提高審評(píng)效率����。
為指導(dǎo)注冊(cè)申請(qǐng)人規(guī)范遞交臨床試驗(yàn)數(shù)據(jù)及相關(guān)資料,以便更好地開展臨床評(píng)價(jià)資料審評(píng)相關(guān)工作��,制定本指導(dǎo)原則���。
本指導(dǎo)原則是在現(xiàn)行法規(guī)和標(biāo)準(zhǔn)體系以及當(dāng)前認(rèn)知水平下制定的�,隨著法規(guī)和標(biāo)準(zhǔn)的不斷完善�����,以及科學(xué)技術(shù)的不斷發(fā)展�,本指導(dǎo)原則的相關(guān)內(nèi)容也將進(jìn)行相應(yīng)的調(diào)整。
二����、適用范圍
本指導(dǎo)原則適用于以產(chǎn)品注冊(cè)為目的開展的醫(yī)療器械臨床試驗(yàn)�����,包括在境外開展的醫(yī)療器械臨床試驗(yàn)��,不適用于按醫(yī)療器械管理的體外診斷試劑臨床試驗(yàn)��。與體外診斷試劑配合使用開展臨床試驗(yàn)的體外診斷設(shè)備和軟件���,如將該臨床試驗(yàn)用于該體外診斷設(shè)備和軟件的注冊(cè)申報(bào),可參考本指導(dǎo)原則提交臨床試驗(yàn)數(shù)據(jù)����,亦可按照《體外診斷試劑臨床試驗(yàn)數(shù)據(jù)遞交要求注冊(cè)審查指導(dǎo)原則》提交臨床試驗(yàn)數(shù)據(jù)。本指導(dǎo)原則僅涉及臨床試驗(yàn)數(shù)據(jù)遞交相關(guān)內(nèi)容�����,不涉及臨床試驗(yàn)過(guò)程中數(shù)據(jù)管理相關(guān)要求����。
三�����、基本原則
(一)真實(shí)原則
所遞交的臨床試驗(yàn)數(shù)據(jù)與臨床試驗(yàn)原始記錄保持一致。
(二)可追溯原則
按照注冊(cè)申請(qǐng)人提交的數(shù)據(jù)����、說(shuō)明性文件和程序代碼,可從原始數(shù)據(jù)庫(kù)重現(xiàn)形成分析數(shù)據(jù)庫(kù)�����、臨床試驗(yàn)報(bào)告中的統(tǒng)計(jì)分析結(jié)果��,且形成的分析數(shù)據(jù)庫(kù)和統(tǒng)計(jì)分析結(jié)果與注冊(cè)申請(qǐng)人提交的內(nèi)容一致�����。
(三)可讀原則
所提交數(shù)據(jù)庫(kù)結(jié)構(gòu)清晰�����,注釋詳盡��,便于審閱�����。按照本指導(dǎo)原則相關(guān)規(guī)范要求遞交臨床試驗(yàn)數(shù)據(jù)有助于提高可讀性����。
四�����、臨床試驗(yàn)數(shù)據(jù)相關(guān)資料及其說(shuō)明
醫(yī)療器械臨床試驗(yàn)數(shù)據(jù)相關(guān)資料通常包括原始數(shù)據(jù)庫(kù)�、分析數(shù)據(jù)庫(kù)���、說(shuō)明性文件和程序代碼��,以下對(duì)各申報(bào)資料具體格式和內(nèi)容提出要求����。鼓勵(lì)注冊(cè)申請(qǐng)人參照臨床數(shù)據(jù)交換標(biāo)準(zhǔn)協(xié)會(huì)(Clinical Data Interchange Standards Consortium�����, CDISC)標(biāo)準(zhǔn)遞交數(shù)據(jù)����。
外文資料提供中文翻譯件時(shí)�����,對(duì)于原始和分析數(shù)據(jù)集,應(yīng)至少翻譯數(shù)據(jù)集����、變量標(biāo)簽、觀測(cè)值中的描述性文本(如不良事件描述等)���。
(一)原始數(shù)據(jù)庫(kù)
遞交的原始數(shù)據(jù)庫(kù)通常包含從病例報(bào)告表和外部文件中直接收集的原始數(shù)據(jù)���,缺失的數(shù)據(jù)在此處不應(yīng)進(jìn)行填補(bǔ)。
原始數(shù)據(jù)庫(kù)通常由多個(gè)不同的原始數(shù)據(jù)集組成��,單個(gè)原始數(shù)據(jù)集是相同主題下多個(gè)變量的集合��,這些變量的觀測(cè)值共同形成該原始數(shù)據(jù)集��,例如�����,人口學(xué)資料數(shù)據(jù)集可包括年齡�����、性別、身體質(zhì)量指數(shù)(Body Mass Index�,BMI)等。不同臨床試驗(yàn)涉及的原始數(shù)據(jù)庫(kù)不完全相同����。單個(gè)原始數(shù)據(jù)集應(yīng)收集相同主題下的變量,不同主題變量建議分別形成原始數(shù)據(jù)集����,例如,膝關(guān)節(jié)Lysholm評(píng)分和IKDC2000評(píng)分相關(guān)變量建議分別形成兩個(gè)原始數(shù)據(jù)集�。
各數(shù)據(jù)集需包括受試者唯一標(biāo)識(shí)變量,以實(shí)現(xiàn)同一受試者不同數(shù)據(jù)集觀測(cè)值的關(guān)聯(lián)�。如涉及不同訪視時(shí)間點(diǎn)觀測(cè)的數(shù)據(jù),應(yīng)使用訪視時(shí)間變量進(jìn)行標(biāo)識(shí)�����。例如����,術(shù)后3個(gè)月和6個(gè)月心臟超聲相關(guān)觀測(cè)值,訪視時(shí)間標(biāo)識(shí)變量可命名為Visit_3��、Visit_6等進(jìn)行區(qū)分�����。若涉及兩個(gè)及兩個(gè)以上臨床試驗(yàn)��,數(shù)據(jù)集中需包括臨床研究標(biāo)識(shí)變量����。若臨床試驗(yàn)采用了隨機(jī)分組,原始數(shù)據(jù)庫(kù)中應(yīng)包含隨機(jī)號(hào)等變量�。
數(shù)據(jù)集和變量命名應(yīng)遵循“可讀性”的原則,建議在對(duì)其命名時(shí)參考數(shù)據(jù)集或變量的英文或拼音�,使得通過(guò)名稱可較容易聯(lián)想到該命名的實(shí)際含義。例如����,可參考“Medical History”將病史數(shù)據(jù)集命名為“MH”,參考“Concomitant Medication”將合并用藥數(shù)據(jù)集命名為“CM”�,將變量“性別”命名為“sex”,變量“受試者姓名縮寫”命名為“sub_abbr”等����。
(二)分析數(shù)據(jù)庫(kù)
分析數(shù)據(jù)庫(kù)是為便于統(tǒng)計(jì)分析使用原始數(shù)據(jù)集形成的數(shù)據(jù)庫(kù),用于產(chǎn)生臨床試驗(yàn)報(bào)告中的統(tǒng)計(jì)結(jié)果(包括基線�����、療效和安全性指標(biāo)統(tǒng)計(jì)分析等)。分析數(shù)據(jù)庫(kù)主要包括原始數(shù)據(jù)庫(kù)中的變量數(shù)據(jù)和按照臨床試驗(yàn)方案和統(tǒng)計(jì)分析計(jì)劃(如有)中事先確定的方法(如缺失值填補(bǔ)����、量表子項(xiàng)評(píng)分加和等)從原始數(shù)據(jù)庫(kù)變量數(shù)據(jù)衍生的數(shù)據(jù)。
分析數(shù)據(jù)庫(kù)通常由多個(gè)不同的數(shù)據(jù)集組成�,這些數(shù)據(jù)集一般與臨床試驗(yàn)報(bào)告中的統(tǒng)計(jì)結(jié)果相對(duì)應(yīng)。例如�,臨床試驗(yàn)報(bào)告中美國(guó)國(guó)立衛(wèi)生研究院卒中量表(NIHSS)評(píng)分統(tǒng)計(jì)結(jié)果可對(duì)應(yīng)專門的分析數(shù)據(jù)集,該分析數(shù)據(jù)集是為了生成NIHSS評(píng)分統(tǒng)計(jì)結(jié)果而專門創(chuàng)建的��,包含生成該統(tǒng)計(jì)結(jié)果的全部變量數(shù)據(jù)�����,其他不相關(guān)變量數(shù)據(jù)不納入到該數(shù)據(jù)集中��。為了便于統(tǒng)計(jì)分析復(fù)驗(yàn)�,分析數(shù)據(jù)集中的變量應(yīng)具有可溯性,變量結(jié)構(gòu)應(yīng)清晰���,不需繁瑣的數(shù)據(jù)前處理即可開展統(tǒng)計(jì)分析�����。
分析數(shù)據(jù)集可基于其產(chǎn)生的相應(yīng)統(tǒng)計(jì)結(jié)果進(jìn)行命名�,例如,生成不良事件比較結(jié)果的數(shù)據(jù)集可命名為“ADAE”(不良事件分析數(shù)據(jù)集)��。建議在分析數(shù)據(jù)集名稱中加入“AD”(analysis data)前綴�,以標(biāo)識(shí)該數(shù)據(jù)集為分析數(shù)據(jù)集�����。
分析數(shù)據(jù)集變量命名同原始數(shù)據(jù)庫(kù)要求��。注意明確不同分析集(如全分析集FAS�、符合方案集PPS和安全分析集SS等)標(biāo)識(shí)變量,以及形成數(shù)據(jù)庫(kù)過(guò)程中產(chǎn)生的系統(tǒng)變量(如有)��,如序號(hào)�、時(shí)間等。
(三)程序代碼
需遞交的代碼主要包括:用于原始數(shù)據(jù)庫(kù)生成分析數(shù)據(jù)庫(kù)的代碼����、分析數(shù)據(jù)庫(kù)生成統(tǒng)計(jì)分析結(jié)果的代碼等,用于調(diào)整格式或生成表格的相關(guān)代碼可不遞交���。遞交的代碼應(yīng)符合通常的編程格式和編程規(guī)范���,結(jié)構(gòu)清晰明了�����,易于閱讀���。程序代碼中應(yīng)包括充分的注釋,以描述不同程序代碼的目的及其他需解釋的內(nèi)容��,幫助審閱者更好地理解代碼邏輯���。如果遞交的程序代碼引用了宏程序��,需提供相應(yīng)的宏程序代碼��,并說(shuō)明運(yùn)行該程序的軟件版本�����、系統(tǒng)環(huán)境���。
(四)說(shuō)明性文件
1.數(shù)據(jù)說(shuō)明文件
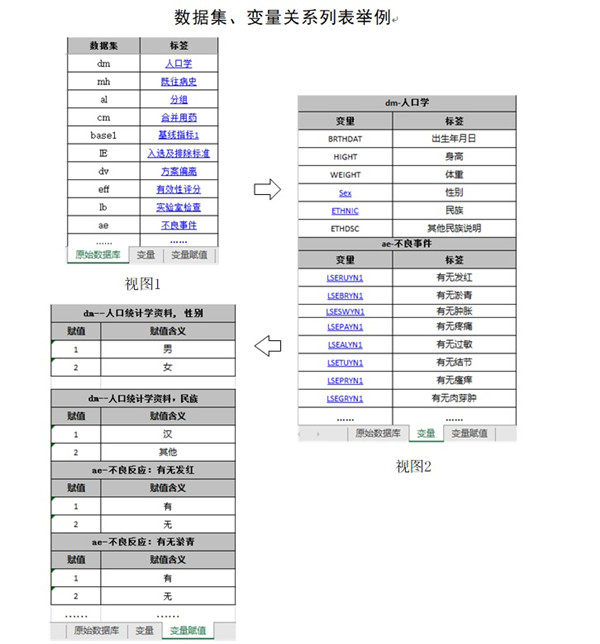
數(shù)據(jù)說(shuō)明文件用于描述原始數(shù)據(jù)庫(kù)和分析數(shù)據(jù)庫(kù)的內(nèi)容和結(jié)構(gòu),有助于審閱者快速了解數(shù)據(jù)庫(kù)中各數(shù)據(jù)集�����、變量及其相互間的結(jié)構(gòu)關(guān)系,準(zhǔn)確理解遞交的數(shù)據(jù)內(nèi)容�����。建議采用Excel文件��,以表格的形式分別列明原始數(shù)據(jù)庫(kù)和分析數(shù)據(jù)庫(kù)中所含的數(shù)據(jù)集��、變量�����、變量類型(如字符型�、數(shù)值型)��、標(biāo)簽�����、賦值及其對(duì)應(yīng)關(guān)系�����,具體可參考附錄1《數(shù)據(jù)集��、變量關(guān)系列表舉例》。為了便于審閱��,數(shù)據(jù)集和變量應(yīng)具有相應(yīng)的中文標(biāo)簽���,標(biāo)簽長(zhǎng)度不宜過(guò)長(zhǎng)�����。若使用了外部詞典(如MedDRA)����,應(yīng)明確使用的外部詞典名稱和版本號(hào)�。
分析數(shù)據(jù)庫(kù)的說(shuō)明文件需列明衍生變量的生成規(guī)則,明確涉及到的變量和計(jì)算方法�。例如,對(duì)缺失值的填補(bǔ)�����,應(yīng)明確填補(bǔ)方法����,提供相應(yīng)的程序代碼。建議以表格的形式列明生成各分析數(shù)據(jù)集所用到的程序代碼文件和原始數(shù)據(jù)集名稱。
2.程序代碼使用說(shuō)明文件
程序代碼使用說(shuō)明文件用來(lái)解釋說(shuō)明程序代碼文件使用方法�����、系統(tǒng)及軟件環(huán)境�����,包括使用代碼文件時(shí)是否需修改以及如何修改程序代碼��。同時(shí)�,以表格形式逐一列明生成各統(tǒng)計(jì)結(jié)果圖表所使用到的程序代碼文件和數(shù)據(jù)集文件名稱。
注冊(cè)申請(qǐng)人應(yīng)說(shuō)明原始數(shù)據(jù)集和分析數(shù)據(jù)集所用編碼(如UTF-8�����、EUC-CN等)����,以避免所遞交的數(shù)據(jù)集出現(xiàn)亂碼的情形�。
3.注釋病例報(bào)告表
相對(duì)于空白CRF,注釋CRF增加了注釋內(nèi)容�����,反映了數(shù)據(jù)庫(kù)中變量與CRF信息收集的對(duì)應(yīng)關(guān)系����。例如����,在性別空白處注釋變量名稱sex�。利用注釋CRF,審閱者可直觀地查閱各變量在CRF中的位置���。CRF中可能收集了一些與臨床試驗(yàn)結(jié)果分析無(wú)關(guān)的冗余數(shù)據(jù)��,這些數(shù)據(jù)可不包含在遞交的數(shù)據(jù)庫(kù)中�,但應(yīng)在注釋CRF上明確標(biāo)注為“不遞交”�,并闡明理由。
4.其他說(shuō)明性文件
除以上說(shuō)明性文件外����,鼓勵(lì)注冊(cè)申請(qǐng)人提交其他有利于審閱者快速了解臨床試驗(yàn)數(shù)據(jù)庫(kù)內(nèi)容和結(jié)構(gòu)的說(shuō)明性文件(如概覽性文件、其他特殊情況說(shuō)明文件等)���。
五�、遞交形式
原始數(shù)據(jù)庫(kù)�、分析數(shù)據(jù)庫(kù)、說(shuō)明性文件和程序代碼分別放置于四個(gè)文件夾中。
原始數(shù)據(jù)庫(kù)和分析數(shù)據(jù)庫(kù)建議采用XPT[1]數(shù)據(jù)傳輸格式遞交�,建議全部原始數(shù)據(jù)集形成一個(gè)XPT文件,全部分析數(shù)據(jù)集形成一個(gè)XPT文件���。建議采用XPT第5版本(簡(jiǎn)稱XPT V5)或以上版本作為數(shù)據(jù)遞交格式���。
數(shù)據(jù)說(shuō)明文件可采用PDF、Word���、Excel等文件格式����,其中變量詞典建議采用Excel文件�,注釋病例報(bào)告表建議采用PDF文件。
程序代碼建議采用TXT文件格式�����。
六���、起草單位
國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心。