MDD指令將于2021年失效,對(duì)于擬申請(qǐng)醫(yī)療器械CE認(rèn)證的企業(yè)來(lái)說(shuō)�,取而代之的是面對(duì)MDR的要求,本文為您科普什么是MDR�����。
引言:MDD指令將于2021年失效���,對(duì)于擬申請(qǐng)醫(yī)療器械CE認(rèn)證的企業(yè)來(lái)說(shuō)��,取而代之的是面對(duì)MDR的要求���,本文為您科普什么是MDR。

醫(yī)療器械CE認(rèn)證之MDR簡(jiǎn)介:
CE為法文CONFORMITE EUROPEENNE的首字母縮寫�,表示“歐洲統(tǒng)一”�����。
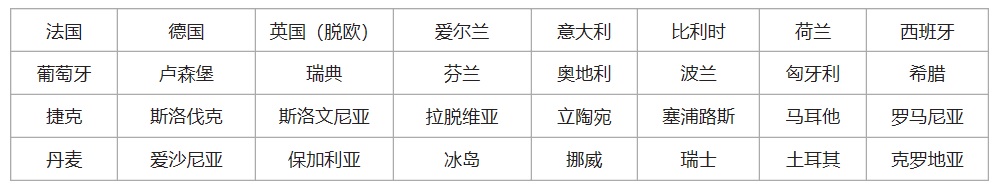
歐盟EU+歐洲自由貿(mào)易聯(lián)盟會(huì)員國(guó)���,英國(guó)脫歐后,共有31個(gè)國(guó)家�����。
很多除歐盟外的國(guó)家�����,除美國(guó)FDA�、日本PAL��、澳大利亞TGA等����,絕大數(shù)通行歐洲頒發(fā)的自由銷售證書CFS。
CE標(biāo)志是一種安全認(rèn)證標(biāo)志�����,凡貼有CE標(biāo)志的產(chǎn)品均可在歐盟各成員國(guó)內(nèi)銷售,無(wú)須符合各個(gè)成員國(guó)的要求�。使用CE標(biāo)志,實(shí)現(xiàn)了商品在歐盟成員國(guó)范圍內(nèi)的自由流通�����,因此CE標(biāo)志被視為制造商打開并進(jìn)入歐洲市場(chǎng)的通行證���。
在歐盟市場(chǎng)“CE”標(biāo)志屬?gòu)?qiáng)制性認(rèn)證標(biāo)志�����,不論是歐盟內(nèi)部企業(yè)生產(chǎn)的產(chǎn)品�����,還是其他國(guó)家生產(chǎn)的產(chǎn)品��,要想在歐盟市場(chǎng)上自由流通��,就必須加貼“CE”標(biāo)志�,以表明產(chǎn)品符合歐盟《技術(shù)協(xié)調(diào)與標(biāo)準(zhǔn)化新方法》法規(guī)的基本要求, 加貼“CE”標(biāo)志必須識(shí)別很多協(xié)調(diào)標(biāo)準(zhǔn)��,這是歐盟法律對(duì)產(chǎn)品提出的一種強(qiáng)制性要求�����。
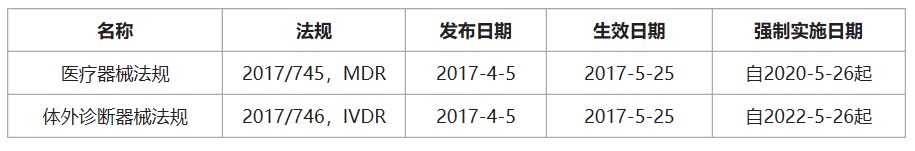
歐盟在2017年4月發(fā)布了醫(yī)療器械法規(guī)(EU)2017/745(MDR),將取代現(xiàn)有的醫(yī)療器械指令(MDD)93/42/EEC����,自2017年5月25日起生效,醫(yī)療器械企業(yè)有3年的過(guò)渡期(即強(qiáng)制實(shí)施日期2020年5月26日)��。MDR與MDD存在明顯差異����。除了其內(nèi)容多了3倍之外,主要差異包括:包括了有源植入性器械和范圍擴(kuò)大至包含具有美學(xué)或非醫(yī)療目的但在功能和風(fēng)險(xiǎn)特征方面類似于醫(yī)療器械的產(chǎn)品�。對(duì)于使用納米材料口服產(chǎn)品的器械有新的分類規(guī)則和符合性審核要求。
在本次發(fā)布的醫(yī)療器械法規(guī)(EU)從原先的Directive(指令)上升為Regulation(法規(guī))���,標(biāo)志著歐盟當(dāng)局對(duì)醫(yī)療設(shè)備領(lǐng)域監(jiān)管的進(jìn)一步重視,同時(shí)也預(yù)示著在歐盟各成員國(guó)內(nèi)醫(yī)療器械監(jiān)管的尺度將得到進(jìn)一步的統(tǒng)一����。
醫(yī)療器械CE認(rèn)證之歐盟醫(yī)療器械法規(guī):
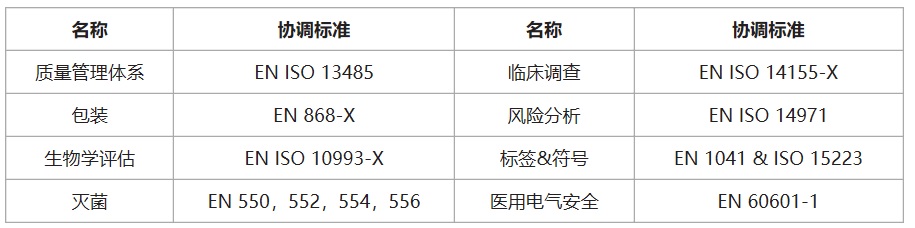
醫(yī)療器械CE認(rèn)證之歐盟醫(yī)療器械協(xié)調(diào)標(biāo)準(zhǔn):
杭州證標(biāo)客醫(yī)藥技術(shù)咨詢有限公司是國(guó)內(nèi)極少數(shù)提供醫(yī)療器械CE認(rèn)證、進(jìn)口醫(yī)療器械注冊(cè)全流程服務(wù)的機(jī)構(gòu)之一����。有任何需求��,歡迎您隨時(shí)方便聯(lián)系葉工18058734169(微信同)���。